Encefalomielitis Aguda Diseminada (EMAD) En niños
INTRODUCCION.-
La EMAD es una enfermedad inflamatoria-desmielinizante del SNC, mediada inmunológicamente, que usualmente sigue a una infección o vacunación, de presentación habitualmente monofásica, que cursa con síntomas neurológicos multifocales, y encefalopatía. Las manifestaciones neurológicas suelen aparecer entre 3 a 6 semanas después de un evento infeccioso o vacuna. El inicio puede ser agudo o progresivo en un período de varios días. Puede afectar cualquier parte del neuroeje, por ello la clínica es muy variable y polisintomática con: alteración del nivel de conciencia, piramidalismo, ataxia cerebelosa, clínica troncoencefálica, neuritis óptica, mielitis y más raramente mieloradiculoneuritis y manifestaciones extrapiramidales. Las crisis epilépticas no son infrecuentes, pueden ser focales o generalizadas, y junto a la fiebre y cefalea pueden ser el debut de la enfermedad. Los cuadros que asemejan una encefalitis son más comunes en los menores de 3 años, donde predomina el cuadro encefalopático.
EPIDEMIOLOGIA.-
La EMAD es la causa más frecuente de afectación de la sustancia blanca en el niño. La incidencia es mayor en la edad prepuberal con una incidencia de aproximadamente 0,2-0,4 casos/100000 habitantes año. Tiene predominio estacional, siendo más frecuente en los meses de invierno y primavera. Afecta más a varones (Leake et al. 2004).
ETIOPATOGENIA.-
En la mayoría de los casos (hasta 75%) existe un antecedente infeccioso previo, aunque en menos del 25% de los casos se confirma el agente infeccioso. Generalmente se tratan de cuadros inespecíficos de infección del tracto respiratorio superior. Los principales virus conocidos implicados son el sarampión, rubéola y varicela zóster. En concreto, el virus del sarampión es el agente etiológico más relacionado con la EMAD, principalmente antes de la vacunación, responsable además de los casos más graves y con mayor mortalidad (alcanzaba una mortalidad del 30%). La probabilidad de presentar una EMAD es de 1:1000 para el virus del sarampión, 1:10.000 para el virus varicela-zoster y 1:20.000 para el virus de la rubéola (Leake et al 2004). Otros virus frecuentemente asociados son: herpes simple 1 y 2, virus de Epstein-Barr, herpes virus humano 6, citomegalovirus, parotiditis, coronavirus, Coxsackie B, hepatitis A, VIH. También se relaciona con otros agentes no víricos como Mycoplasma pneumoniae, Campylobacter, Chlamydia y estreptococo beta-hemolítico. Menos del 5% de los casos se asocian a vacunaciones, son las denominadas EMAD postvacunación, relacionadas principalmente con la triple vírica. La incidencia de EMAD postvacunación del sarampión es de 1-2/1000000, frente al 1/1000 con el virus salvaje. Otras vacunas implicadas son la de la gripe, diphtheria/pertussis/tetanos, hepatitis B y neumococo.
PATOGENIA.-
Se reconoce una base autoinmune desencadenada por un estímulo ambiental sobre individuos genéticamente predispuestos. Se ha postulado que un antígeno común compartido por el agente infeccioso y la mielina desencadena una respuesta autoinmunitaria , en la que participan linfocitos T del tipo CD4+ y CD8+, frente a antígenos de la mielina, como la proteína básica de la mielina (PBM), la proteína proteolipídica y la glicoproteína de la mielina del oligodendrocito. También se implica a los linfocitos B en la respuesta inmunitaria a través de anticuerpos antigangliósidos (GM1). Estos y otros mecanismos conducen a la desmielinización y lesión axonal. La histología de la EMAD muestra áreas de inflamación y desmielinización perivenosas, con infiltración por monocitos, neutrófilos y macrófagos. En estadio tardío se observan hiperplasia astrocítica y gliosis (Palace et al. 2011).
CLÍNICA.-
En el 75% de los casos existe el antecedente de un cuadro febril sistémico entre 2 y 30 días antes del inicio de los síntomas neurológicos. La clínica inicial incluye: fiebre, cefalea, mialgias, meningismo, náuseas, vómitos y afectación del estado general, que habitualmente persisten durante el período agudo. A continuación, se observan signos y síntomas neurológicos multifocales que se desarrollan de forma progresiva, alcanzando el máximo entre el 4º y el 7º día desde el inicio del cuadro, y pueden durar entre 2 y 4 semanas (Hynson et al. 2001). Existe afectación de vías motoras (piramidal, extrapiramidal, cerebelosa) y sensitivas, del tronco cerebral, e incluso del sistema nervioso periférico en forma de radiculoneuritis.
Los signos y síntomas predominantes son: hemiparesia (76%), afectación de vías largas con hiperreflexia, espasticidad, o respuesta cutáneo-plantar extensora (85%), y cambios del estado mental (69%). Otros síntomas frecuentes son: ataxia, neuropatías craneales, oftalmoparesia, neuritis óptica, crisis convulsivas y, en los casos más graves, estupor, coma y trastornos respiratorios. La afasia, los movimientos anormales, y los trastornos sensitivos son menos frecuentes (Jayakrishnan et al. 2010).
Existen variantes hiperagudas hemorrágicas de EMAD, infrecuentes, pero de peor pronóstico, en las que existe una desmielinización hemorrágica de la sustancia blanca del SNC. Estas incluyen: leucoencefalitis aguda hemorrágica, encefalomielitis aguda hemorrágica y leucoencefalitis aguda hemorrágica necrotizante de Weston Hurst. Estas variantes hemorrágicas tienen un curso más severo, con peor pronóstico de supervivencia y secuelas neurológicas (Anlar et al. 2003). El LCR es típicamente hemorrágico, y hay que diferenciarlo de un líquido traumático.
DIAGNÓSTICO.-
No existen marcadores que permitan confirmar el diagnóstico de EMAD, y es preciso apoyarse en elementos clínicos y paraclínicos (Krupp et al 2007). Las principales claves diagnósticas son:
- Antecedente de cuadro infeccioso o vacunación entre 2-30 días antes de inicio del cuadro neurológico en un niño previamente sano.
- Sintomatología neurológica polisintomática y multifocal, junto con encefalopatía
- Lesiones desmielinizantes multifocales en la sustancia blanca subcortical, núcleos basales, tronco cerebral y/o médula espinal, detectadas en la RM.
- Ausencia de bandas oligoclonales de IgG en el LCR.
- Curso monofásico. Para confirmar esto se requiere un seguimiento prolongado, lo que enfatiza que el diagnóstico definitivo habitualmente es retrospectivo
PRUEBAS COMPLEMENTARIAS.-
Laboratorio.-Deben incluirse estudios analíticos básicos. Puede encontrarse elevación de marcadores inflamatorios inespecíficos (linfocitosis, aumento de proteína C reactiva y velocidad de sedimentación globular).
Microbiología.-Es preciso realizar estudios microbiológicos: cultivos, serologías (frente a los gérmenes más frecuentemente implicados: VEB, CMV, VHS, VVZ, rubéola y mycoplasma), frotis faríngeos para cultivo de virus (gripe en período estacional) y/o estudio de heces, en un intento de encontrar el agente infeccioso implicado.
Punción Lumbar.-El estudio de LCR puede ser normal, o mostrar alteraciones inespecíficas en el 20-80% de los casos (pleocitosis de predominio linfocitario y/o elevación de proteínas). Es preciso realizar estudios microbiológicos en LCR para descartar una meningoencefalitis vírica o bacteriana. Con frecuenica se inicia tratamiento empírico con antibióticos y/o aciclovir hasta confirmar resultados microbiológicos negativos (Murthy et al. 2002). Puede existir una presión de apertura aumentada que refleja la existencia de una hipertensión intracraneal.
Bandas oligoclonales.-Es de gran utilidad para el diagnóstico diferencial entre la EMAD y un primer brote de esclerosis múltiple (EM) la determinación de bandas oligoclonales Ig G en LCR, que son positivas en el 40-95% de pacientes con EM. En los infrecuentes casos de EMAD con bandas IgG positivas (<30%) se observa negativización meses después, mientras que en los casos de EM las bandas de IgG oligoclonales se mantienen positivas en el tiempo (Tenembaum et al. 2007).
Neurofisiología.- El estudio de la velocidad de conducción nerviosa puede determinar una afectación del sistema nervioso periférico, ocasionalmente presente en EMAD pero no en EM. Los potenciales evocados somatosensoriales (PESS) valoran la afectación de tronco o medular. Los potenciales evocados auditivos de tronco (PEAT) también detectan disfunción de tronco cerebral. Los potenciales evocados visuales confirman la afectación de la vía visual aferente, en especial de neuritis óptica, que es generalmente unilateral en la EM y bilateral en la EMAD (Dale et al 2000).
El electroencefalograma (EEG) muestra frecuentemente una lentificación difusa del trazado de base en la EMAD, correlato del grado de encefalopatía que habitualmente existe. Puede observarse actividad epileptiforme intercrítica y con menor frecuencia crítica.
Neuroimagen.-
- TC cráneo. Con frecuencia es normal. Ocasionalmente podría mostrar lesiones hipodensas en parénquima cerebral y cerebelo. Puede mostrar datos indirectos de edema cerebral.
- RM craneal y espinal. Es la técnica de imagen de elección. Resultan de especial utilidad las secuencias ponderadas en T2 y FLAIR. En las fases agudas las lesiones pueden captar contraste. Los hallazgos neuroradiológicos pueden progresar en el tiempo, conforme evoluciona la enfermedad. Respecto a la relación temporal entre la clínica y la aparición de alteraciones en la RM cerebral puede existir un desfase clínico-radiológico de 2 a 25 días entre el inicio de los síntomas y la detección de lesiones en la RM (Hynson et al. 2001).
Típicamente existen lesiones desmielinizantes en sustancia blanca cortico-subcortical y profunda, bilaterales pero característicamente asimétricas, y que respetan la sustancia blanca periventricular. El tamaño de las lesiones varía entre <5mm hasta 5 cm. Las lesiones más grandes se asocian con efecto masa. Es frecuente la existencia de focos desmielinizantes en la sustancia gris, en especial en ganglios basales y tálamos y, en menor proporción, en la corteza cerebral. La afectación de tálamos y ganglios basales es típicamente simétrica y pueden ser la única alteración radiológica en algunos casos (Hynson et al 2001). También puede existir afectación del tronco cerebral, cerebelo y médula espinal. Ciertas características de las lesiones, como son: lesiones solitarias, grandes unilaterales, corticales, o talámicas bilaterales son altamente sugestivas de una EMAD. Callen propone que la existencia de al menos 2 de los siguientes criterios se correlacionan con el desarrollo de EM con una sensibilidad y especificidad del 81 y 95% respectivamente:
- ≥2 lesiones periventriculares.
- Presencia de agujeros negros (lesiones hipointensas en T1).
- Ausencia de un patrón de distribución difusa bilateral
CRITERIOS DIAGNÓSTICOS DE EMAD. Consensus definitions proposed for pediatric multiple sclerosis and related disorders. (Krupp et al. 2007)
FORMAS CLÍNICAS
La EMAD presenta un curso monofásico en la mayoría de los casos, pero existen pacientes con una o más recidivas. Estas formas recurrentes y multifásicas se definen por la aparición de síntomas nuevos una vez pasados los 3 primeros meses desde el evento inicial, o más allá del primer mes tras la retirada completa de corticoides (Dale et al 2000). Por definición, ambas presentaciones clínicas deben cursar de nuevo con encefalopatía. El pronóstico de estas variantes es igualmente hacia la curación. Tanto en la forma recurrente como en la multifásica, la aparición de nuevos episodios suele estar autolimitada en el tiempo, y suele existir una recuperación completa (Palace et al. 2011).
-Forma recurrente, describe la recurrencia de los mismos síntomas que ocurrieron en el primer episodio. Característicamente, las recidivas en la EMAD ocurren antes de los seis meses, afectan a los mismos territorios que en el primer episodio y no se repiten. La RM debe ser similar a la primera y no deben existir lesiones nuevas en diferentes localizaciones, aunque se admite que pudieran tener un tamaño mayor que las originales.
-Forma multifásica, describe la recurrencia de síntomas que cumplen criterios de EMAD pero que afectan a diferentes áreas anatómicas del SNC. Los síntomas y la neuroimagen son diferentes a los del primer episodio, y deben existir lesiones nuevas en la RM craneal, con la completa o parcial resolución de las asociadas al primer episodio.
DIAGNÓSTICO DIFERENCIAL.
El diagnóstico diferencial es amplio. Una vez descartada la etiología infecciosa, es primordial definir los criterios clínicos y paraclínicos que apoyen el diagnóstico de EMAD, diferenciándola de la EM y otras enfermedades desmielinizantes: neuritis óptica, mielitis transversa y neuromielitis óptica de Devic (Tenembaum et al 2007). Otros cuadros a considerar son otras encefalitis asociadas a virus, principalmente al virus de la gripe como la encefalopatía aguda necrotizante, enfermedades reumatológicas (vasculitis sistémicas, angeítis primaria del SNC, neurosarcoidosis, LES, enfermedad de Behçet), enfermedades metabólicas y mitocondriales ,leucodistrofias, etc…
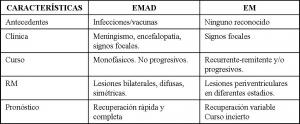
Tabla 2. Diagnóstico diferencial EMAD y EM.
Las principales características radiológicas que permiten diferenciar la EMAD de la EM son las siguientes (Krupp et al. 2007):
- EMAD habitualmente tiene más lesiones que la EM, con afectación bilateral de la sustancia blanca más extensa pero asimétrica.
- Las lesiones de la EMAD tiene márgenes peores definidos que en la EM.
- En la EMAD las lesiones están habitualmente en el mismo estadio evolutivo, mientras que en la EM suelen existir lesiones en diferente estadio (las más antiguas suelen ser hipointensas en T1).
- Las lesiones talámicas, principalmente si son bilaterales, son más sugestivas de EMAD.
- Las lesiones periventriculares son menos frecuentes en la EMAD y más típicas de la EM.
TRATAMIENTO.
En la mayoría de las ocasiones, y dado el nivel de conciencia de los pacientes, es preciso su ingreso en una unidad de cuidados intensivos pediátricos. Además del soporte vital ocasionalmente precisan medicación antiepiléptica si se presentan con crisis. Raramente existe hipertension intracraneal, la cual es más frecuente en las formas hemorrágicas, y también precisará un tratamiento específico.
El tratamiento de elección de primera línea en la EMAD son altas dosis de corticoides intravenosos (grado evidencia 2C). Deben iniciarse cuanto antes y pueden usarse conjuntamente con antibióticos y aciclovir. El uso concomitante de aciclovir hasta que se descarte la etiología herpética tiene la doble utilidad de tratar una posible etiología herpética y de no postergar la administración de metilprednisolona en la EMAD.
Cuando fracasan los corticoides iv o existe una respuesta insuficiente, las inmunoglobulinas intravenosas y la plasmaféresis son las siguientes opciones terapeúticas (grado evidencia 2C). No obstante, la efectividad de estos 3 tratamientos como primera o segunda línea de tratamiento(corticoides, inmunoglobulinas y plasmaféresis) no ha sido definitivamente confirmada, ya que no existen ensayos clínicos que determinen el tratamiento más óptimo, incluyendo dosis y duración del mismo.
La elección del tratamiento de segunda línea, a falta de estudios aleatorizados, controlados, debería ser individualizado, dependiendo de la severidad de la enfermedad, complicaciones y comorbilidad asociada, así como de los medios disponibles en cada servicio. Así por ejemplo, ante la existencia de afectación del sistema nervioso periférico podría resultar más efectivo el tratamiento con inmunoglobulinas iv, mientras que la plasmaféresis parece particularmente beneficiosa en combinación con corticoides cuando existe afectación medular extensa (mielitis transversa con extensión longitudinal extensa).
La metilprednisolona iv es de primera elección (10-30mg/Kg/día, habitualmente 30 mg/Kg/día, hasta un máximo de 1 g/día), durante 3 a 5 días (habitualmente 5 días). Con este tratamiento se describe una recuperación completa entre el 50-80% de los pacientes. Generalmente, la mejoría se evidencia a las 24-48 horas del inicio de la terapia esteroidea. Posteriormente se recomienda completar el tratamiento con corticoides vía oral, con un descenso gradual de dosis, hasta un total de 4 a 6 semanas en aquellos niños que tras completar el tratamiento con megadosis iv de corticoides continúen con síntomas clínicos.
Para los niños que no han presentado una mejoría significativa tras 5 días con altas dosis de metilprednisolona, se recomienda inmunoglobulinas iv. Las dosis y pautas de inmunoglobulinas iv más frecuentemente utilizadas son: 2g/Kg (dosis total) dividida en 2 o 3 días o 0,4 g/Kg/día durante 5 días. Habitualmente la mejoría se aprecia a los 2 o 3 días de iniciado el tratamiento.
Otra alternativa en estos casos es la plasmaféresis, generalmente de 4 a 6 sesiones. También se indica la plasmaféresis cuando existe un deterioro clínico o falta de mejoría tras la terapia con corticoides e inmunoglobulinas, o cuando existe afectación medular extensa . Una pauta adecuada sería por ejemplo 6 sesiones, una cada 2 días, con recambios de 1 a 1,5 volúmenes de plasma (Khurana et al. 2005).
Las variantes hemorrágicas hiperagudas de la ADEM tienen peor pronóstico en cuanto a supervivencia y secuelas neurológicas. Está descrito que el tratamiento precoz con altas dosis de corticoides se asocian a un mejor pronóstico en niños y adultos. En estas variantes sí se recomienda continuar con corticoides orales (Anlar et al. 2003). Existen casos descritos donde se ha utilizado otros inmunosupresores como la ciclofosfamida, junto a los corticoides, inmunoglobulinas y plasmaféresis. Puntualmente se ha requerido incluso la realización de un craniectomía descompresiva en casos que han cursado con una grave hipertensión inracraneal en el contexto de edema cerebral difuso que no respondió a tratamiento médico.
PRONÓSTICO.
La mayoría de los niños con una EMAD se recuperan por completo, habitualmente lo hacen lentamente a lo largo de 4 a 6 semanas. En el seguimiento a largo plazo el 60-90% no tiene ningún déficit neurológico o es mínimo. En las series de los últimos años se reporta una mínima o ausente mortalidad (Palace et al. 2011). En las décadas anteriores a la vacunación sistematizada de la población la mortalidad de la EMAD postinfecciosa alcanzaba el 20%, principalmente la forma asociada al sarampión (Analr et al. 2003).
La extensión y localización de las lesiones en la RM no predice el pronóstico clínico. Las secuelas más frecuentes son los déficit motores, en forma de hemiparesia o paraparesia, habitualmente leve, ataxia, epilepsia focal, disminución de agudeza visual y trastornos del aprendizaje (Murthy et al. 2002).
Las formas hiperagudas hemorrágicas, que cursan con mayor afectación clínica y con habitual ausencia de respuesta a los corticoides tienen de peor pronóstico.
SEGUIMIENTO A LARGO PLAZO.
Es preciso un seguimiento clínico y de neuroimagen de los niños que han padecido una EMAD para confirmar este diagnóstico de forma retrospectiva. Además del seguimiento clínico se recomienda la realización de, al menos, 2 RM craneales adicionales, después de la primera normal tras el episodio inicial, en un período mínimo de 5 años desde el primer episodio, para confirmar la ausencia de nuevas lesiones inflamatorias desmielinizantes.
BIBLIOGRAFIA.
• Anlar B, Basaran C, Kose G, et al. Acute disseminated encephalomyelitis in children: outcome and prognosis. Neuropediatrics 2003; 34:194.
• Dale RC, de Sousa C, Chong WK, et al. Acute disseminated encephalomyelitis, multiphasic disseminated encephalomyelitis and multiple sclerosis in children. Brain 2000; 123 Pt 12:2407.
• Hynson JL, Kornberg AJ, Coleman LT, et al. Clinical and neuroradiologic features of acute disseminated encephalomyelitis in children. Neurology 2001; 56:1308.
• Jayakrishnan MP, Krishnakumar P. Clinical profile of acute disseminated encephalomyelitis in children. J Pediatr Neurosci. 2010 Jul; 5(2):111-4.
• Khurana DS, Melvin JJ, Kothare SV, et al. Acute disseminated encephalomyelitis in children: discordant neurologic and neuroimaging abnormalities and response to plasmapheresis. Pediatrics 2005; 116:431.
• Krupp LB, Banwell B, Tenembaum S; International Pediatrics MS Study Group. Consensus definitions proposed for pediatric multiple sclerosis and related disorders.Neurology. 2007. Apr 17; 68 (16 Suppl 2): S7-12.
• Leake JA, Albani S, Kao AS, et al. Acute disseminated encephalomyelitis in chilhood: epidemiologic, clinical and laboratory features. Pediatr Infect Dis J 2004; 23:756.
• Murthy SN, Faden HS, Cohen ME, Bakshi R. Acute disseminated encephalomyelitis in children. Pediatrics 2002; 110:e21.
• Nishikawa M, Ichiyama T, Hayashi T, et al. Intravenous immunoglobulin therapy in acute disseminated encephalomyelitis. Pediatr Neurol 1999; 21:583.
• Palace J. Acute disseminated encephalomyelitis and its place amongst other acute inflammatory demyelinating CNS disorders. J Neurol Sci. 2011 Jul 15; 306 (1-2):188-91.
• Tenembaum S, Chitnis T; Ness J, Han J for the International Pediatric MS Study Group. Acute disseminated encephalomyelitis. Neurology. 2007. Apr 17; 68 (16 Suppl 2): S23-26.