Metabolopatía neonatal con deterioro neurológico
INTRODUCCIÓN
Los principales errores congénitos del metabolismo (ECM) que se manifiestan con síntomas de alteración de la conciencia en forma de letargia o coma en el periodo neonatal son:
1.- ECM tipo “intoxicación”:
El síntoma inicial suele ser la dificultad para la succión y alimentación, que progresivamente evolucionan hacia hipotonía, somnolencia, vómitos y coma. Posteriormente asocian síntomas neurovegetativos (hipo, apneas, bradicardia, hipotermia); movimientos involuntarios tipo opistótonos, pedaleo, boxeo, temblor; y pueden asociar crisis epilépticas.
- Aminoacidopatías: enfermedad de la orina con olor a jarabe de arce (leucinosis o EOOJA), fenilcetonuria, hiperglicinemia no cetósica…
- Acidurias orgánicas.
- Trastornos del ciclo de la urea.
- Trastornos de los neurotransmisores.
2.- ECM tipo “alteración del metabolismo energético”:
Suelen manifestarse como hipotonía que rápidamente progresa hacia un deterioro neurológico. Pueden asociar otros problemas como dismorfias, problemas cardiacos, hepáticos…
- Defectos de beta oxidación de los ácidos grasos.
- Trastornos mitocondriales.
3.- ECM tipo “alteración de moléculas complejas”
- Lisosomales.
- Peroxisomales.
Como clave diagnóstica orientativa hacia el tipo de ECM: hay algunos trastornos en los que se afecta fundamentalmente el patrón respiratorio (apneas) y requieren ventilación mecánica:
- Aminoacidopatías: hiperglicinemia no cetósica, leucinosis.
- Epilepsia dependiente de piridoxina y piridoxal fosfato.
- Trastorno del metabolismo de la biotina.
- Deficiencia de MTHFR.
- Trastornos de la betaoxidación.
- Trastornos mitocondriales: defectos del metabolismo del piruvato, síndrome de depleción del DNA mitocondrial, trastornos de la cadena respiratoria mitocondrial.
- Ceroidolipofuscinosis de presentación neonatal
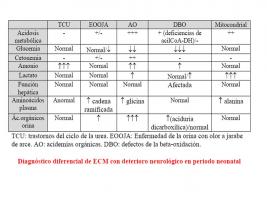
PRINCIPALES ECM CON DETERIORO NEUROLÓGICO
- Hiperglicinemia no cetósica
Alteración en el sistema enzimático mitocondrial que metaboliza la glicina, lo que provoca un acúmulo de glicina en LCR. La glicina en los recién nacidos es un neurotransmisor inhibidor a nivel de tronco y médula, pero excitador en córtex. Autosómica recesiva. Alteración de los genes: GLDC (75%), GCSH y AMT (25%).
- Clínica
La forma clínica más común es la que se presenta en los primeros días de vida en forma de encefalopatía progresiva: hipotonía, letargia con progresión posterior a coma y muerte. Es muy frecuente que presenten episodios de apnea, llegando a requerir ventilación mecánica en 70%. Son frecuentes también crisis con gran componente mioclónico, que pueden comenzar intraútero. El hipo puede ser una clave diagnóstica (Korman et al; 2002).
- Diagnóstico
Diagnóstico de sospecha: cociente glicina LCR/plasma >0,06-0,08 (valores normales <0,02) (Van Hove et al; 2011).
Diagnóstico de confirmación: cuantificación de la actividad enzimática en hepatocitos o análisis de mutaciones.
- Pruebas complementarias
Neuroimagen: asocian alteraciones cerebrales en el 33% de los casos: agenesia del cuerpo calloso, hidrocefalia, alteraciones de la sustancia blanca (aumento de señal en secuencias de difusión), alteraciones de la migración.
EEG: brote-supresión.
- Pronóstico
En general, mal pronóstico, con muerte en los primeros meses de vida hasta en el 33%. Hay casos publicados de encefalopatía transitoria por glicina.
- Tratamiento
No hay tratamiento efectivo; aunque se usan el benzoato sódico para disminuir los niveles de glicina y el dextrometorfano como antagonista de los canales NMDA. Contraindicado usar ácido valproico, mejor control de crisis con benzodiacepinas.
- Enfermedad de la orina con olor a jarabe de arce (leucinosis)
Trastorno autosómico recesivo del complejo multienzimático mitocondrial de la deshidrogenasa de alfa-cetoácidos de cadena ramificada; lo que provoca el acúmulo de aminoácidos esenciales de cadena ramificada (leucina, isoleucina y valina) y sus cetoácidos. De todos ellos, es el acúmulo de leucina el que es especialmente tóxico para el sistema nervioso central provocando edema cerebral y alteración en la sustancia blanca (Lyon et al; 2006).
- Clínica
Suele producir síntomas en periodo neonatal; tras un intervalo libre de síntomas (desde el nacimiento hasta 2 semanas) se inicia clínica de intoxicación: estupor, alteración de la respiración (apnea), hipertonía con episodios de opistótonos, convulsiones; posteriormente se puede desarrollar coma y muerte. Hay una variante que cursa con oftalmoplegia. Clave clínica: olor de la orina a azúcar quemado (jarabe de arce).
- Diagnóstico
Diagnóstico de sospecha: detección de alfacetoácidos en orina. Niveles elevados de aminoácidos ramificados y cetoácidos en orina, sangre y LCR.
Diagnóstico de confirmación: análisis de la actividad enzimática en fibroblastos o linfocitos o por análisis de DNA.
- Pronóstico:
Existe una considerable mejoría neurológica o incluso curación si se corrigen los cetoácidos a niveles normales en los primeros días. Se pueden producir recaídas provocadas por infecciones o situaciones de estrés que se asocian a episodios de edema cerebral.
- Tratamiento:
Dieta exenta de aminoácidos de cadena ramificada. En algunos casos puede ser útil administrar tiamina.
- Acidurias orgánicas
Son un grupo de enfermedades metabólicas, autosómicas recesivas, muy heterogéneas.
- Clínica
Los síntomas son bastante similares, pareciéndose a la clínica de la leucinosis. Tras un intervalo libre de síntomas se inicia un cuadro neurológico de tipo intoxicación: rechazo del alimento, vómitos, deshidratación; con posterior aparición de letargia, hipotonía, convulsiones, hipertonía con temblor de gran amplitud o mioclonías, episodios de apnea, hipotermia pudiendo llegar al coma y muerte. Como pistas clínicas en la acidemia isovalérica es frecuente el olor de la orina a “pies sudados”; en la acidemia propiónica y metilmalónica la aparición de un rash cutáneo (Wendel et al; 2006).
- Pruebas complementarias
Neuroimagen: en la acidemia metilmalónica pueden encontrarse alteración de la sustancia blanca, dilatación ventricular y alteración del cuerpo calloso (Radmanesh et al; 2008).
- Diagnóstico
- Diagnóstico de sospecha: acidosis metabólica con anión GAP elevado y cetonemia/cetonuria e hiperamoniemia. Frecuente neutropenia, trombopenia y/o anemia. Puede haber moderada hiperlactacidemia.
Detección de ácidos orgánicos y de sus metabolitos en sangre y orina. Hipocarnitinemia en la aciduria metilmalónica.
- Diagnóstico de confirmación: detección de la deficiencia enzimática en fibroblastos. También es posible el estudio genético de mutaciones.
- Tipos
Las que más frecuentemente se presentan en periodo neonatal son (Campistol et al; 2007):
1. Acidurias orgánicas de aminoácidos de cadena ramificada
1.1.- Aciduria isovalérica (IVA): déficit de isovaleril–CoA deshidrogenasa (dentro de la vía de degradación de la leucina). Gen IVD.
1.2.- Aciduria propiónica (PA): déficit de propionil-CoA carboxilasa (alteración del metabolismo de la biotina). Gen PCCA y PCCB.
1.3.- Aciduria metilmalónica (MMA): déficit de metilmalonil-CoA mutasa que tiene como cofactor la vitamina B12. Puede ser el resultado de:
1.3.1.- Defecto en la apomutasa. Genes MUT, MMAA y MMA.
1.3.2.- Defectos en la biosíntesis de vitamina B12. Gen MMAHC.
2. Otras: deficiencia de 3-metilcrotonil-CoA carboxilasa (hipotonía, letargia y crisis), deficiencia de 2-metil-3-hidroxibutiril-CoA deshidrogenasa (crisis), aciduria glutárica.
- Tratamiento
El inicio del tratamiento debe ser urgente por el peligro de daño neurológico irreversible o incluso la muerte. Los objetivos son:
• Corregir acidosis, hipermoniemia e hipoglucemia.
• Restricción proteica.
• Eliminación rápida del sustrato tóxico: mediante diálisis y administración de cofactores como carnitina y glicina (isovalérica). Valorar metronidazol para reducir la producción de propionato por bacterias intestinales (propiónica).
• Empleo de cofactores para mantenimiento: biotina (propiónica) o hidroxicobalamina (metilmalónica).
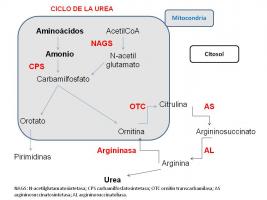
- Trastornos del ciclo de la urea
El ciclo de la urea es un grupo de reacciones enzimáticas dirigidas a eliminar el amonio, producido en el catabolismo de los aminoácidos, en forma de urea.
La deficiencia de cualquiera de esas enzimas produce diferentes tipos de trastorno del ciclo de la urea (TCU). Todos se transmiten de forma autosómica recesiva excepto el déficit de OTC que es recesivo ligado a X.
- Clínica
Encefalopatía aguda por acúmulo de amonio. Se suelen presentar en periodo neonatal, tras un periodo asintomático (1-5 días) en forma de síntomas de tipo intoxicación: problemas de alimentación, vómitos, hiperventilación, irritabilidad, hipotermia, opistótonos, convulsiones que puede llevar al coma-muerte si no se instaura tratamiento.
Todas tienen una clínica similar, aunque algunas tienen claves diagnósticas específicas como la tricorrexis nodosa en la aciduria argininosuccínica, despigmentación retiniana en el HHH...
Síndrome HHH (Hiperornitinemia-Hiperamoniemia-Homocitrulinuria): defecto en el transportador de ornitina a la mitocondria. Se caracteriza por niveles elevados de orinitina, hiperamoniemia postpandrial (intolerancia a las proteínas) y homocitrulinuria.
- Diagnóstico
Diagnóstico de sospecha: hiperamoniemia, alcalosis respiratoria y anión GAP normal.
Diagnóstico de diferentes tipos de TCU: la determinación de citrulina, argininosuccínico y ácido orótico en plasma permiten diferenciar el tipo de TCU. Así por ejemplo los niveles de citrulina están muy elevados en el déficit de AS.
Diagnóstico definitivo: detección de mutaciones.
- Pruebas complementarias:
EEG: lentificación difusa. Brote-supresión en citrulinemia.
RM cerebral: edema cerebral y alteraciones de la sustancia blanca difusa.
- Pronóstico
Depende del tiempo que se tarde en instaurar tratamiento. Se pueden presentar episodios intermitentes de hiperamoniemia desencadenados por infecciones o ingesta de proteínas (Picca et al; 2001).
- Tratamiento
Restricción proteica. Administración de quelantes de amonio: benzoato sódico, fenilacetato, fenilbutirato, hemodiálisis, ácido carglúmico (Carbaglu®).
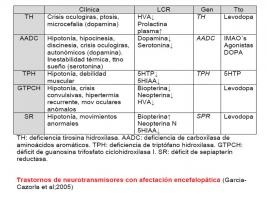
- Trastornos de los neurotransmisores
Los trastornos de los neurotransmisores constituyen un grupo de enfermedades heterogéneas del sistema nervioso central conocidas recientemente. Son trastornos de la neurotransmisión causados por déficit en su síntesis (la mayoría), liberación anormal, alteración de la recaptación o disfunción de los receptores postsinápticos.
- Clínica
Cursan sin afectación extraneurológica, con clínica inespecífica y fluctuante que varía dependiendo del neurotransmisor deficitario. En el caso del metabolismo de la dopamina, serotonina y pterinas (que son los que vamos a repasar en este capítulo) se manifiestan fundamentalmente mediante una encefalopatía grave precoz. La deficiencia de cada neurotransmisor provoca una sintomatología característica aunque no específica; así la deficiencia de dopamina se caracteriza por hipomimia, hipocinesia, sintomatología autonómica (hipersalivación, miosis), ptosis, crisis oculogiras, fluctuación a lo largo del día y discinesias; mientras que el déficit de serotonina ocasiona fundamentalmente anomalías en la regulación de la temperatura y del sueño. La tetrahidrobiopterina es una cofactor de TH y TPH, por lo que es fundamental en la síntesis de dopamina y serotonina, y su deficiencia provoca una clínica de hipotonía grave. Es también cofactor de la fenilalanina hidroxilasa por lo que su déficit puede provocar hiperfenilalaninemia.
- Diagnóstico
- Diagnóstico de sospecha: perfil característico de neurotransmisores en LCR.
- Diagnóstico definitivo: cuantificación de la actividad enzimática o determinación de mutaciones.
BIBLIOGRAFIA
- Campistol J, Boveda MD, Couce ML, Lluch MD, Merinero MD. (2007). Acidemia orgánica. Protocolo de diagnóstico y tratamiento de las acidemias propiónica, metilmalónica e isovalérica. En: Sanjurjo P, Couce M, Pintos G, Ribes A, Merinero B(eds). Protocolos de Diagnóstico y Tratamiento de los Errores Congénitos del Metabolismo, (pp27-51). Madrid:Enar.
- García-Cazorla A, Ormazábal A, Artuch R, Pérez-Dueñas B, López-Casas J et al. (2005). Errores congénitos de los neurotransmisores en Neuropediatría. Rev Neurol. 41:99-108.
- Korman SH, Gutman A. (2002) Pitfalls in the diagnosis of glycine encephalophaty (non-ketotic hyperglycinemia). Dev Med Child Neurol 44:712-720.
- Lyon G. (2006). The neurology of neonatal hereditary metabolic diseases. En: Lyon G, Kolodny EH, Pastores GM (Ed), Neurology of hereditary Metabolic diseases of children, (pp9-64). McGraw-Hill.
- Picca S, Dionisi-Vici C, Abeni D, Pastore A, Rizzo C et al. (2001). Extracorporeal dialysis in neonatal hyperammonemia: modalities and prognostic indicators. Pediatr Nephrol. 16:862-867.
- Radmanesh A, Zaman T, Ghanaati H, Molaei S, Robertson RL et al. (2008). , Zamani AA. Pediatr Radiol. Methylmalonic acidemia: brain imaging findings in 52 children and a review of the literature. 38:1054-1061.
- Van Hove J, Lohr NJ. (2011). Metabolic and monogenic causes of seizures in neonates and young infants. Mol Genetics and Metabolism. 104:214-220.
- Wendel U, Ogier de Baulny H. Branched-Chain Organic Acidurias/Acidemias. (2006). En: Fernandes J, Saudubray JM, Van Den Berghe G,Walter J (eds). Inborn Metabolic Diseases,(pp 245-262). Berlín:Springer.