Tratamiento de las crisis epilépticas y de la epilepsia en el niño
Es necesario hacer un cuidadoso balance entre el beneficio y los posibles efectos adversos derivados del tratamiento con fármacos antiepilépticos (FAE). No se trata pues de controlar las crisis a cualquier precio. En la actualidad, el objetivo primordial del tratamiento de la epilepsia es mejorar, de forma global, la calidad de vida de los pacientes.
-¿Por qué se deben tratar las crisis epilépticas?
Existen muchos datos a favor y también algunos argumentos en contra de tratar las crisis epilépticas en el niño (Gutiérrez-Solana et al; 1998, Blume; 2006, Camfield et al; 2003, García-Peñas; 2011, García-Peñas et al; 2007, Shinnar et al; 2002, Chuang et al; 2007, Perucca et al; 2005b).
Datos a favor de tratar.
Los datos a favor de tratar derivan de las consecuencias psicosociales de las crisis, la repercusión neurocognitiva de la epilepsia y las descargas epileptiformes interictales y el potencial daño cerebral derivado de crisis repetidas y status epilépticos (Gutiérrez-Solana et al; 1998, Blume; 2006, Camfield et al; 2003, García-Peñas et al; 2007, García-Peñas; 2011).
Datos en contra de tratar.
Los datos en contra de tratar derivan de la evolución natural autolimitada de un gran número de las epilepsias de la infancia y del potencial efecto nocivo cognitivo y sistémico de los FAE (Gutiérrez-Solana et al; 1998, Shinnar et al; 2002, Chuang et al; 2007, Perucca et al; 2005b).
Así, por ejemplo, las crisis parciales motoras simples leves, las que se presentan sólo durante el sueño, las crisis esporádicas y, en la edad escolar, un grupo de epilepsias “benignas” que remiten habitualmente en la pubertad. Por lo tanto, es necesario hacer un cuidadoso balance entre el beneficio y los posibles efectos secundarios derivados del empleo de los fármacos antiepilépticos (Gutiérrez-Solana et al; 1998, Shinnar et al; 2002, Chuang et al; 2007, Perucca et al; 2005b). No se trata sólo de controlar las crisis epilépticas; en la actualidad, el objetivo primordial del tratamiento de la epilepsia es mejorar, de forma global, la calidad de vida del paciente (Perucca et al; 2005b).
-Consideraciones generales del tratamiento antiepiléptico.
Se deben considerar factores ligados al episodio paroxístico, factores relacionados con el paciente, factores psicosociales, factores derivados del propio médico y factores relacionados con el fármaco a elegir. Se trata de factores importantes que condicionan iniciar o no un tratamiento con FAE y qué tipo de FAE vamos a usar en cada caso.
- Factores propios de la epilepsia.
Se incluyen aquí datos variados de la epilepsia como son el tipo de episodio paroxístico, tipo de crisis epiléptica, tipo de síndrome epiléptico, etiología de la epilepsia, frecuencia de las crisis, patocronía de las crisis, riesgo de recurrencia evolutiva de las crisis tras un primer episodio, posibles factores precipitantes de las crisis y despistaje precoz de un potencial curso refractario.
- Tipo de episodio paroxístico (Devinsky et al; 2011, Benbadis; 2009, Kanner; 2008, Perucca et al; 2005b). Hay una alta frecuencia de episodios paroxísticos en los niños, sobre todo entre los lactantes (Devinsky et al; 2011). Existe mayor frecuencia de TPNE que de epilepsia. Hasta un 20-30% de las supuestas epilepsias son TPNE (Benbadis; 2009). Hay una alta frecuencia de pseudocrisis en adolescentes y a veces éstas coinciden con auténticas crisis epilépticas (Kanner; 2008). Es fundamental conocer el tipo, semiología y evolución de los distintos TPNE para diferenciarlos de las epilepsias y evitar el sobretratamiento (Perucca et al; 2005b).
2. Tipo de crisis epiléptica (Hsieh et al; 2008, Foldvary-Schaefer et al; 2011, Wang et al, 2001). Existe una mayor frecuencia global de crisis parciales en los niños. Pero no todo se reduce a diferenciar entre crisis parciales (CP) y crisis generalizadas (CG), dado que son frecuentes los episodios motores menores, sobre todo en lactantes, de difícil diferenciación entre CP y CG (Hsieh et al; 2008). Por otra parte, es frecuente la coexistencia de varios tipos de crisis. Además, no existe siempre una clara relación entre la semiología de las crisis y el patrón EEG intercrítico o incluso con el patrón de EEG crítico (Foldvary-Schaefer et al; 2011). No se debe olvidar que no siempre hay una clara relación entre la semiología de las crisis y el patrón de lesiones en neuroimagen (por ejemplo, espasmos epilépticos en lesiones focales y CP en leucoencefalopatías difusas) (Wang et al; 2001). Por ello, ante la duda del tipo de crisis, es preferible siempre usar un FAE de amplio espectro.
3. Tipo de síndrome epiléptico (Wheless; 2009, Foulon et al; 2011). Para definir bien el síndrome epiléptico hemos de considerar la edad de debut, los tipos de crisis, los patrones de EEG, la etiología y la evolución clínico-EEG. Es fundamental conocer que muchos de ellos son síndromes epilépticos edad-dependientes. Esto nos permite orientar la petición de pruebas complementarias, realizar una predicción pronóstica y plantear un adecuado diagnóstico diferencial. Por otra parte, una mejor delimitación del tipo de síndrome epiléptico es básica para conocer cuáles son los FAE más idóneos en cada caso (por ejemplo, valproato para el síndrome de Dravet) y evitar aquellos FAE perjudiciales (por ejemplo, lamotrigina en el síndrome de Dravet).
4. Etiología de la epilepsia (Zupanc; 2009, Sillanpää et al; 2009, Stafstrom; 2009, Prasad et al; 2010). Existe un alto porcentaje global de epilepsias idiopáticas en los niños, una alta tasa de epilepsias con base genética en niños escolares y adolescentes y una alta tasa de epilepsias secundarias en lactantes y neonatos (Zupanc; 2009). Es importante saber que hay una alta tasa de malformaciones del desarrollo cortical en el grupo de las epilepsias refractarias (Zupanc; 2009). Por otra parte, aunque son globalmente infrecuentes como etiologías, las metabolopatías congénitas tienen una importante repercusión sobre el tratamiento (determinados FAE como valproato pueden empeorar el curso de enfermedades como acidurias orgánicas y citopatías mitocondriales) (Prasad et al; 2010). Además, debemos recordar que el pronóstico de la epilepsia va ligado sobre todo a la edad de debut y a la etiología (Sillanpää et al; 2009 Zupanc; 2009). El mejor conocimiento de la etiología de la epilepsia nos va a permitir conocer su evolución natural y el posible desarrollo precoz de epilepsias refractarias (por ejemplo, displasias corticales focales) y nos va a ayudar a seleccionar nuestro tratamiento (por ejemplo, vigabatrina en esclerosis tuberosa, valproato para mutaciones del gen SCN1A, tratamiento quirúrgico precoz en las hemimegalencefalias, etc.). Por otro lado, podemos evitar FAE perjudiciales para ciertas etiologías (por ejemplo, lamotrigina, carbamazepina y oxcarbazepina en las mutaciones del gen SCN1A) (Stafstrom; 2009).
5. Frecuencia de las crisis epilépticas (Sillanpää et al; 2009, Schmidt; 2009). En el niño, es frecuente la presencia de crisis epilépticas únicas u ocasionales, por lo cual es raro que tengamos que empezar a tratar con FAE desde la primera crisis. Hay determinadas crisis con alta tasa de recurrencia desde el inicio (por ejemplo, ausencias, espasmos y mioclonías) y esto condiciona un tratamiento con FAE desde el debut de las mismas. Existen ciertos síndromes epilépticos con frecuentes crisis y evolución refractaria (por ejemplo, síndrome de West y síndrome de Lennox-Gastaut), mientras que otros tienen pocas crisis y rara vez son refractarios (por ejemplo, epilepsia rolándica benigna y síndrome de Panayiotopoulos). Existen etiologías con una muy alta tasa de crisis y evolución refractaria (por ejemplo, malformaciones del desarrollo cortical y esclerosis mesial temporal) y otras con baja tasa de crisis y de refractariedad (por ejemplo, crisis tras infartos cerebrales en el niño). El manejo de toda esta información es fundamental para considerar o no un tratamiento precoz de las crisis epilépticas con FAE.
6. Patocronía de las crisis (Sillanpää et al; 2006, Beume et al; 2010). Según la evolución del niño y de la enfermedad epiléptica, podemos asistir a un cambio en la semiología de las crisis (por ejemplo, una esclerosis tuberosa con crisis focales iniciales y posteriormente espasmos epilépticos). Por otra parte, las encefalopatías epilépticas pueden modificar su semiología clínico-EEG según la edad (un síndrome de Ohtahara cambia a un síndrome de West y éste a un síndrome de Lennox). Algunos síndromes desarrollan crisis polimorfas durante su evolución natural (por ejemplo, el síndrome de Dravet, con desarrollo inicial de crisis febriles complejas y posteriormente ausencias, mioclonías y crisis parciales). Toda esta información sobre la patocronía nos permite seleccionar el FAE más idóneo y condiciona una potencial politerapia racional combinando diversos FAE según la evolución.
7. Riesgo de recurrencia tras una primera crisis (Berg; 2008, Haut et al; 2008, Sillanpää et al; 2009, Perucca; 2008, Winckler et al; 1997). Este porcentaje varía, según las distintas series desde un 27% a un 84% (Haut et al; 2008, Berg; 2008). El máximo riesgo de recurrencia se da en los 6 primeros meses tras la primera crisis y se mantiene con riesgo potencial hasta los 2 años tras la primera crisis (Winckler et al; 1997). Los factores más importantes de recurrencia son la etiología de las crisis y la presencia o no de un EEG patológico al inicio (Berg; 2008). Con respecto al tipo de crisis, la recurrencia es más alta en las crisis parciales que en las crisis generalizadas y es mayor en las crisis sintomáticas remotas que en las idiopáticas. Sin embargo, no parece tener un peso específico independiente el hecho de que la primera crisis sea un status epiléptico (Winckler et al; 1997). Todos estos factores van a condicionar nuestra decisión de iniciar o no un tratamiento con FAE tras una primera crisis epiléptica.
8. Factores precipitantes de las crisis (Fang et al; 2008, Verrotti et al; 2005) Se incluye aquí la influencia del ciclo vigilia-sueño (por ejemplo, crisis que casi siempre aparecen en sueño, como las de la epilepsia rolándica benigna, y crisis que predominan al despertar, como los espasmos epilépticos) y las crisis estímulo-sensibles (por ejemplo, las epilepsias fotosensibles y las epilepsias del sobresalto). Estos datos pueden orientar hacia determinados síndromes y etiologías, condicionan adoptar unas medidas adicionales de terapia (por ejemplo, evitar estímulos fóticos desencadenantes) y condicionan el empleo de determinados FAE (por ejemplo, valproato y levetiracetam para las epilepsias fotosensibles).
9. Conocer el potencial curso refractario de la epilepsia (Granata et al; 2009, Briggs et al; 2003). Se debe identificar precozmente una posible refractariedad, ya sea por la presencia de determinados tipos de crisis (por ejemplo, mioclonías o espasmos), por el síndrome epiléptico (por ejemplo, encefalopatías epilépticas neonatales, síndrome de West, síndrome de Lennox, o epilepsia parcial continua), y/o por la etiología (por ejemplo, malformaciones del desarrollo cortical, esclerosis mesial temporal, esclerosis tuberosa, síndrome de Sturge-Weber, o enfermedad de Rasmussen). Por todo ello, se debe considerar precozmente la posibilidad de derivar a estos pacientes a una Unidad de Epilepsia Refractaria para considerar sin mucha demora la posibilidad de cirugía resectiva o de tratamientos alternativos a ésta, como el estimulador del nervio vago y la dieta cetogénica, antes de seguir probando múltiples combinaciones de FAE que van a ser casi siempre ineficaces en estos casos.
- Factores propios del paciente.
Analizaremos diversos factores como son la edad del niño, sexo del niño (sobre todo, en la edad adolescente), factores genéticos, datos ligados a la farmacogenómica, aspectos neuropsicológicos, patología comórbida psiquiátrica, condiciones médicas asociadas, otros fármacos administrados (interacciones), capacidad del niño para tragar pastillas o cápsulas, posible estigma por ser epiléptico y potencial estigma por tomar medicación antiepiléptica a diario.
1. Edad del niño (Deprez et al; 2009, Porter; 2008 Durá-Travé et al; 2009, Collins; 2011). Se debe considerar que existe una distinta semiología de crisis según las distintas edades, que la maduración cerebral va a condicionar el patrón clínico, que cada edad muestra distintos síndromes epilépticos y distintas etiologías (por ejemplo, metabolopatías congénitas en los menores de 2 años), que existe un distinto metabolismo de los FAE según las distintas edades (sobre todo entre neonatos y lactantes), que se describen peculiaridades de farmacocinética para las distintas edades y los distintos FAE (sobre todo en la edad madurativa crítica de los 2 primeros años), y que hay distintos márgenes de dosis en mg/Kg/día según las edades. Todos estos factores van a condicionar la elección de un determinado FAE, la pauta de dosis, el número de tomas y las posibles asociaciones de FAE. Por otra parte, hay que considerar las peculiaridades del adolescente epiléptico, dado que estos pacientes no aceptan bien el diagnóstico, ocultan información sobre sus crisis, es difícil que cumplan las normas generales del tratamiento y que se tomen la medicación a diario, tienen un metabolismo distinto de los FAE, y se preocupan en mayor grado por factores psicosociales diversos (estigma, esfera sexual y aspectos cosméticos, entre otros) (Collins; 2011).
2. Sexo del niño (Bar-Dayan et al; 2010). Estas diferencias son llamativas en la adolescencia. Se deben considerar en las niñas los posibles condicionantes cosméticos, el problema de la ganancia excesiva de peso, factores de función sexual y reproductiva, potenciales interacciones con anticonceptivos orales y el, tan olvidado en el campo de la neuropediatría, problema de la teratogenicidad. Todos estos factores deben hacernos evitar, en principio, el empleo de determinados FAE como valproato entre las chicas adolescentes.
3. Aspectos genéticos (Deprez et al; 2009, Sánchez et al; 2010, Poduri et al; 2011, Pestian et al; 2009, Cascorbi; 2010). Los factores genéticos modulan etiologías específicas de algunas epilepsias (por ejemplo, canalopatías epilépticas SCN1A), determinan factores de farmacocinética (por ejemplo, tipo de actividad de citocromos hepáticos), y condicionan una potencial fármacorresistencia (por ejemplo, relacionada con transportadores de FAE, como la glicoproteína P). Todos estos datos constituyen las bases de la farmacogenómica, que busca realizar un tratamiento con FAE “a la carta”, combinando la información sobre canales iónicos, receptores neuronales, metabolismo de FAE y posible refractariedad ligada a farmacocinética. Existen en la actualidad en el mercado determinados kits de farmacogenómica que investigan estos parámetros en la saliva del paciente (por ejemplo, FARMAGEN-EPILEPSIA®, de laboratorios Rubió). Esta información es aún limitada, pero podría ser de gran utilidad si se realizara en el paciente epiléptico de reciente diagnóstico para conocer mejor la potencial respuesta a los FAE más frecuentemente prescritos, anticiparse al desarrollo de reacciones idiosincrásicas por FAE y conocer algunos de los factores de la fármacorresistencia.
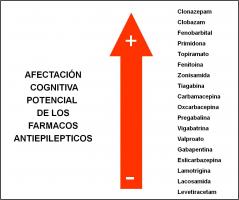
4. Factores neuropsicológicos (Mandelbaum et al; 2009, Bhise et al; 2010, Taylor et al; 2010, Vijayaraghavan et al; 2011, Eddy et al; 2011). Las alteraciones del aprendizaje y de distintas funciones neuropsicológicas son muy frecuentes en la epilepsia infantil, ya sea por la propia evolución natural de la epilepsia (deterioro ligado a las crisis), por el tipo de síndrome epiléptico (por ejemplo, deterioro evolutivo en el síndrome de Dravet), por el efecto deletéreo de las encefalopatías epilépticas y/o por el efecto de los FAE. Se afectan fundamentalmente la atención, la memoria y el lenguaje. Ningún FAE está libre de estos efectos nocivos (ver “afectación cognitiva de los FAE.jpg”)
, que son mucho más frecuentes si usamos politerapia. Estas alteraciones van a condicionar nuestras opciones de tratamiento, principalmente en la etapa crítica del neurodesarrollo (menores de 2 años de edad). Es importante pues que conozcamos el perfil neurocognitivo de cada FAE.
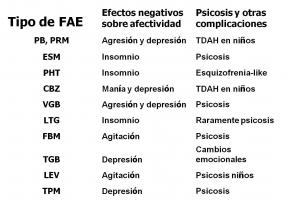
5. Patología neuropsiquiátrica (Van Mil et al; 2009, Bujureanu et al; 2010, LaFrance et al; 2008). Es una comorbilidad muy frecuente en epilepsia infantil, incluyendo déficit de atención con hiperactividad, retraso mental con alteraciones de conducta, trastornos del espectro autista (con o sin retraso mental), alteración del control de impulsos y el binomio psicosis-epilepsia. También debemos reseñar el efecto deletéreo de los FAE sobre la conducta y el estado de ánimo (ver “aspectos psicotrópicos de los FAE.jpg”).
Es importante además conocer la influencia de determinadas medicaciones prescritas a estos pacientes (estimulantes, neurolépticos, antidepresivos) sobre el control de la epilepsia y la farmacocinética de los distintos FAE.
6. Influencia de la patología médica asociada (Kargiotis et al; 2011, Abou Khaled et al; 2008). Debemos prestar especial atención a los pacientes con patología crónica (renal, hepática, cardiaca, hematológica, oncológica, respiratoria y/o digestiva) que condicionan alteraciones en la farmacocinética y farmacodinámica de los FAE, principalmente en el niño con patología hemato-oncológica (Kargiotis et al; 2011). Es importante además conocer la especial situación del niño con patología aguda crítica con fallo multiorgánico que experimenta con frecuencia crisis agudas de difícil manejo con FAE. Por otra parte, en este último grupo, se deben considerar aquellos casos de encefalopatía aguda con crisis epilépticas, fallo multisistémico y necesidad de “polifarmacia” (Abou Khaled et al; 2008). En todos estos pacientes “sistémicos”, crónicos o agudos, es donde debemos tener en mente las interacciones de los fármacos (antineoplásicos, antibióticos, sedantes, analgésicos, inmunosupresores, etc.) con los FAE, y los potenciales efectos sistémicos de los FAE (principalmente, los llamados FAE clásicos o de primera generación). En estas patologías es donde son especialmente útiles algunos de los nuevos FAE, o FAE de segunda generación, como el levetiracetam, por su excelente farmacocinética y su ausencia casi total de interacciones.
7. Problemas para cumplimentar el tratamiento y vivencia de estigma (Thomas et al; 2011, Fernandes et al; 2011). Debemos considerar la falta de adecuación del tratamiento al niño, con el problema de tragar pastillas o cápsulas y la falta de presentaciones pediátricas para muchos de los FAE del mercado nacional. Con respecto a la limitación por el factor estigmatizador de la epilepsia, se incluyen aquí el estigma por la “palabra maldita” epilepsia (cargada aún de tantas connotaciones negativas), el estigma por tomar medicación del área del SNC (con todos los falsos mitos que aún rodean al cerebro en nuestra cultura), el estigma por tomar medicación a diario (como una marca en el inconsciente), y el estigma por tomar medicación en la escuela (donde se mantienen aún muchos prejuicios y miedos frente a la epilepsia).
- Factores psicosociales.
Consideraremos una serie de datos que no siempre se tienen en cuenta y que incluyen aspectos como duración prevista del tratamiento, posible estigma social por el tratamiento, repercusión familiar, repercusión escolar, actitud del niño y de los padres ante la terapia, cumplimiento futuro del tratamiento, coste del tratamiento, disponibilidad de FAE según países y disponibilidad de FAE según Seguros Médicos.
1. Duración prevista del tratamiento (Camfield et al; 1993). Va a relacionarse con la edad de debut de las crisis, con la patología neurológica asociada, con la etiología de la epilepsia, con el tipo de síndrome epiléptico y con las anomalías del registro EEG previo a la potencial retirada del FAE. Dado que el tratamiento con FAE se ha de mantener entre 1-5 años, según el tipo de epilepsia y síndrome epiléptico, debemos estar muy seguros a la hora de tomar la decisión de iniciar un tratamiento crónico con FAE.
2. Repercusión psicosocial de la epilepsia (Rafael et al; 2010). Se debe conocer la actitud del niño y sus padres ante la enfermedad y ante la decisión de tratar con FAE, no se debe olvidar el potencial estigma por la enfermedad y/o por tratamiento, y además hay que conocer la actitud de la escuela ante la epilepsia y ante el tratamiento. Todos estos factores pueden condicionar un rechazo a iniciar el tratamiento con FAE o pueden imposibilitar un adecuado cumplimiento de la terapia.
3. Aspectos económicos y sociosanitarios (Simoens; 2010, Olesen et al; 2012, Cañadillas et al; 2009, Gómez-Alonso et al; 2008). Son importantes en todo momento y principalmente en nuestra situación actual de crisis económica y recesión mantenida. Debemos destacar el alto coste de la epilepsia como enfermedad crónica (múltiples y caras pruebas complementarias, numerosas visitas a los Servicios de Urgencias, y frecuente hospitalización con estancias prolongadas). Por otra parte, se debe reseñar el alto precio de sus tratamientos, principalmente el de los FAE de segunda y tercera generación, así como el de las otras modalidades de tratamiento como la cirugía de la epilepsia y el sistema de estimulación del nervio vago. Aunque no es un tema que nos afecte en España, hay que conocer que existe muy distinta disponibilidad de FAE según países (en países del Tercer Mundo tan sólo existen algunos de los FAE clásicos) y la distinta disponibilidad de FAE según el modelo sanitario (en algunos países, no están financiados los FAE de segunda y tercera generación). Todas estas consideraciones pueden condicionar nuestra decisión de tratar, aunque no debemos ser meros agentes “economicistas”, recetando FAE genéricos a todos los epilépticos, dado que no debemos olvidar que esa fluctuación permitida por ley de hasta un 20% en la pureza del FAE puede condicionar que no obtengamos niveles terapéuticos eficaces y el fracaso de nuestro tratamiento (Cañadillas et al; 2009, Gómez-Alonso et al; 2008).
- Factores propios del médico que prescribe.
Son muy importantes pero poco conocidos y valorados. Se incluyen aquí (NICE; 2012, Serrano-Castro et al; 2005, Sánchez-Álvarez et al; 2005, American Academy of Pediatrics; 2011, Hirtz et al; 2003, French et al; 2004, Panayiotopoulos et al; 2005, Payakachat et al; 2006, Riviello et al; 2006, Meierkord et al; 2006, Glauser et al; 2006) prescripciones según la experiencia propia personal (“a mí me va bien”), opinión de expertos de cada país, guías de tratamiento de distintas sociedades científicas internacionales y nacionales (National Institute for Health and Clinical Excellence, American Academy of Neurology, American Academy of Epilepsy, American Academy of Pediatrics, European Federation of Neurological Sciences, Child Neurology Society, Sociedad Andaluza de Epilepsia), protocolos de tratamiento de cada hospital, y datos de epilepsia basada en la evidencia (guías de la International League Against Epilepsy).
- Factores relacionados con los propios fármacos antiepilépticos.
La prescripción médica se relaciona con datos de farmacodinámica, farmacocinética, modalidades de presentación del fármaco, número de tomas diarias, opción de monoterapia versus politerapia, interacciones con fármacos distintos de los FAE, perfil previsible de efectos adversos (EA), posibilidad de reacciones idiosincrásicas EA crónicos del FAE (efectos neurocognitivos), teratogenicidad y consideración precoz de otras opciones de tratamiento distintas de los FAE (cirugía, dieta cetogénica, estimulador del nervio vago, etc.).
1. El FAE ideal en la edad pediátrica (Perucca et al; 2003). Es aquel FAE capaz de eliminar las crisis sin producir efectos adversos importantes, es decir respetando la calidad de vida. Entre las características ideales, se incluyen: posible administración por vía oral y por vía parenteral, formulación cómoda y sencilla para el niño, absorción completa y no modificable por la toma de fármacos o alimentos, vida media prolongada (una única dosis al día), cinética lineal predecible, mínima unión a proteínas plasmáticas, ausencia de interacción con otros fármacos, rango terapéutico alto, existencia de un antídoto, que no produzca tolerancia ni adición, ausencia de efectos adversos, amplio espectro terapéutico y adecuado balance eficacia-seguridad.
2. Monoterapia versus politerapia (Baulac; 2003, Armijo et al; 2007a, Armijo et al; 2007b, Armijo et al; 2007c). Con la monoterapia se obtiene respuesta hasta en un 80% de los pacientes (Baulac; 2003), se toleran dosis más altas de un solo FAE (mayor eficacia global), se tienen menos efectos adversos, no hay interacciones, el tratamiento es más sencillo para el niño y esto asegura un mejor cumplimiento. Por otra parte, con la politerapia se puede lograr una respuesta positiva en un 10-15% de los que no respondieron a monoterapia (Armijo et al; 2007a), sobre todo si se aprovechan los efectos sinérgicos de determinados FAE (por ejemplo, valproato con lamotrigina), en el contexto de la denominada “politerapia racional” (Armijo et al; 2007a, Armijo et al; 2007b, Armijo et al; 2007c). Sin embargo, con la politerapia, existen múltiples interacciones, hay más efectos adversos y pueden presentarse potenciaciones negativas de toxicidad, sobre todo si se combinan FAE con un mecanismo de acción similar (por ejemplo, carbamazepina y lamotrigina).
3. El problema de los efectos adversos de los FAE (Cruz-Campos et al; 2000, Gilliam; 2002, Sarco et al; 2010, Glauser; 2004a, Verrotti et al; 2011, Räty et al; 1999, Perucca et al; 2005a, Perucca et al; 2005b, Cramer et al; 2010, Genton; 2000, Chaves et al; 2005). Los efectos adversos (EA) de los FAE contribuyen al fracaso terapéutico hasta en un 40% de los casos (Gilliam; 2002), condicionando una alta tasa de falta de efectividad y de falta de eficacia. Los EA de los FAE son frecuentes entre pacientes con epilepsia en la edad pediátrica y, en este grupo de edad, ningún FAE es completamente seguro (Perucca et al; 2005a). Se estima que el 60-70% de los pacientes experimentan EA con los FAE clásicos (Sarco et al; 2010). Para algunos pacientes, los EA de los FAE son la mayor preocupación de su enfermedad (Perucca et al; 2005a). La mayor inquietud de los padres del niño epiléptico incide en los aspectos cognitivos y conductuales (Perucca et al; 2005b, Glauser; 2004). A largo plazo, los EA pueden comprometer gravemente la calidad de vida del niño epiléptico (EA cognitivos y EA psicosociales) (Räty et al; 1999). Algunos EA pueden conducir a la muerte del paciente (hepatitis, pancreatitis, aplasia medular, síndrome de Stevens-Johnson y síndrome de Lyell). Muchos de los EA graves, principalmente los idiosincrásicos, ocurren al inicio del tratamiento (durante las primeras 4-6 semanas) (Sarco et al; 2010).
Atendiendo a la etiopatogenia y la patocronía de los EA por FAE, podemos clasificar estos en 4 categorías distintas (A, B, C, D) (Cruz-Campos et al; 2000, Perucca et al; 2005a, Perucca et al; 2005b, Cramer et al; 2010). Los de tipo A (dosis-dependientes) constituyen hasta el 95% del total de los EA, están ligados al mecanismo de acción del FAE, suelen ser agudos, predecibles y evitables en parte, y se presentan frecuentemente como EA neurológicos y/o digestivos. Los de tipo B (por susceptibilidad individual o hipersensibilidad) representan menos del 5% del total de los EA por FAE, no están relacionados con el mecanismo de acción del FAE, son imprevisibles y difícilmente evitables, y se presentan como EA cutáneos (exantemas, eritema multiforme, síndrome de Stevens-Johnson, síndrome de Lyell, etc.), hematológicos (leucopenia, anemia aplásica, trombopenia, reducción del factor VIII), y/o digestivos (hepatitis, pancreatitis). Los de tipo C (crónicos) aparecen tras un periodo de tratamiento prolongado, tienen un curso insidioso e incluyen problemas diversos como trastornos neurocognitivos y conductuales, hiperplasia gingival, osteomalacia, alteraciones endocrinológicas y/o pérdida o ganancia excesiva de peso. Los de tipo D (teratogenicidad) incluyen diversas malformaciones congénitas por exposición prenatal a FAE y el potencial retraso madurativo que pueden experimentar los niños hijos de madres epilépticas tratadas con FAE durante la gestación.
Por otra parte, todos los FAE pueden agravar la evolución natural de la epilepsia, al potenciar las crisis existentes o bien facilitando la aparición de nuevos tipos de crisis, especialmente en pacientes con epilepsias generalizadas idiopáticas y en el estado de mal eléctrico durante el sueño lento (Genton; 2000, Chaves et al; 2005) (ver “FAE y agravamiento de la epilepsia.jpg”).
Con el fin de mejorar la tolerabilidad del tratamiento, es fundamental pues una elección adecuada del FAE (conocer bien el perfil de cada FAE), ajustar el perfil del individuo al perfil del fármaco y no al revés, evitar el sobretratamiento, evitar politerapias agresivas e irracionales, evitar tratamientos prolongados de forma injustificada e indagar sobre la presencia de EA en cada revisión e intentar medir estos con escalas específicas.
PLAN SECUENCIAL DE TRATAMIENTO ANTIEPILÉPTICO.
Debemos intentar un tratamiento global de la epilepsia, incluyendo medidas preventivas, información sobre el tratamiento y uso racional de los FAE.
Sólo consideraremos que una epilepsia es refractaria cuando hayamos realizado el plan de etapas de tratamiento de forma racional y secuencial.
-Uso clínico de los FAE.
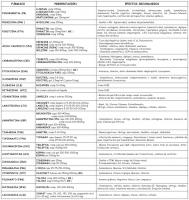
Es importante que estemos familiarizados con las características básicas de farmacocinética y farmacodinámica de los distintos FAE, así como con su espectro antiepiléptico y su balance eficacia-tolerabilidad (ver “FAE disponibles.jpg”) y (ver “interacciones de los FAE.jpg”).
FAE clásicos o FAE de primera generación (Brodie; 2010, Herranz; 2004, Shorvon et al; 2004, Pellock et al; 2008a, Silberstein et al; 2011, Taketomo et al; 2008).
Se describen aquí aquellos FAE comercializados en España antes del año 1.990. Tienen unas características comunes que incluyen (Herranz; 2004): mecanismos de acción no siempre bien definidos o conocidos, eficacia antiepiléptica bien probada a lo largo de los años, dosis bien establecida en pautas de mg/Kg/día, eficacia contrastada en monoterapia, perfil de seguridad conocido, posibilidad de reacciones idiosincrásicas potencialmente graves, frecuentes problemas de farmacocinética, múltiples interacciones con otros FAE y con otros fármacos, necesitan muchas veces ajustar dosis mediante niveles séricos, necesitan en algunos casos de controles analíticos seriados, pero son globalmente muy baratos.
En este grupo, se incluyen fenobarbital (PB), primidona (PRM), fenitoína (PHT), ácido valproico (VPA), carbamazepina (CBZ), etosuximida (ESM), sultiamo (STM), clonazepam (CNZ) y clobazam (CLB). Con el tiempo, han desaparecido del mercado nacional algunos FAE como la acetilurea y el nitrazepam.
1.Fenobarbital (PB) (Herranz; 2004, Michelucci et al; 2004, Rust; 2008, Silberstein et al; 2011, Taketomo et al; 2008). Ventajas: tiene eficacia contrastada frente a crisis generalizadas tipo Gran Mal y frente a crisis parciales. Existe además una formulación parenteral, lo cual facilita su empleo en las convulsiones agudas y en el SE. Sigue siendo un FAE de primer nivel para el tratamiento de las convulsiones en el neonato y en el niño menor de 1 año, por su valor terapéutico contrastado, su buena absorción y su fácil administración. Por otra parte, puede administrarse de forma crónica en tan sólo 1-2 tomas al día.
Inconvenientes y defectos: presenta múltiples interacciones farmacocinéticas
y farmacodinámicas (PHT, VPA, CBZ) y produce frecuentes efectos adversos neurocognitivos y comportamentales (hiperactividad, trastornos de conducta, déficit de atención, alteraciones del patrón de sueño y/o somnolencia). Esta presencia de efectos secundarios neurológicos y conductuales ha condicionado que se emplee cada vez menos en la edad infantil.
2. Primidona (PRM) (Herranz; 2004, Michelucci et al; 2004, Rust; 2008, Silberstein et al; 2011, Taketomo et al; 2008).
Se transforma en el organismo en PB y otros metabolitos activos (PEMA) con poder antiepiléptico.
Ventajas: tiene un perfil terapéutico similar al PB, pero potenciado por actuar además sobre las crisis mioclónicas. Es además un FAE con un buen potencial para crisis focales, sobre todo cuando se asocia con CBZ.
Inconvenientes y defectos: presenta un perfil de interacciones y efectos adversos neurocognitivos similar al PB, lo cual limita actualmente su empleo. Por otra parte, no se puede administrar por vía parenteral.
3. Fenitoína o difenilhidantoína (PHT, DPH) (Herranz; 2004, Eadie; 2004, Dodson; 2008a, Silberstein et al; 2011, Taketomo et al; 2008).
Ventajas: tiene un amplio espectro terapéutico frente a crisis parciales y crisis generalizadas tipo Gran Mal, se puede emplear por vía intravenosa (i.v.) para el tratamiento de las convulsiones agudas y el status epiléptico (SE), y se puede administrar de forma crónica en tan sólo 1-2 tomas al día.
Inconvenientes y defectos: presenta una absorción errática, tiene una cinética no lineal dosis-dependiente (riesgo de toxicidad por aumentos discretos en la dosis total diaria), posee múltiples interacciones farmacocinéticas (VPA, PB, PRM, CBZ), puede empeorar determinadas crisis (ausencias, mioclonías y crisis atónicas), tiene alta tasa de efectos adversos neurológicos (ataxia, nistagmus, deterioro neurocognitivo evolutivo, diplopia) y cosméticos (hirsutismo, hiperplasia gingival, hinchazón facial).
4. Carbamazepina (CBZ) (Herranz; 2004, Sillampää; 2004, Dodson; 2008b, Silberstein et al; 2011, Taketomo et al; 2008).
Ventajas: posee una eficacia bien contrastada en crisis parciales y en crisis tónico-clónicas generalizadas.
Inconvenientes y defectos: tiene frecuentes interacciones farmacocinéticas (VPA, PB, PHT), presenta una cinética no lineal dosis-dependiente decreciente, puede ser necesario administrarla en 3 dosis para minimizar efectos adversos, se metaboliza hacia un compuesto tóxico (epóxido-CBZ), puede exacerbar determinadas crisis (ausencias, mioclonías y crisis atónicas) y empeorar el trazado EEG (riesgo de punta-onda continua en sueño lento en pacientes con epilepsias parciales), puede producir reacciones de hipersensibilidad cutánea (exantemas hasta en un 25% de los casos) (Dodson; 2008b), presenta con relativa frecuencia efectos adversos neurológicos (nistagmus, diplopia, ataxia) y existe riesgo de desarrollar discrasias sanguíneas (principalmente, leucopenia y neutropenia). Por otra parte, no se dispone de una formulación parenteral para el manejo de las crisis agudas.
5. Valproato sódico / Ácido Valproico (VPA) (Herranz; 2004, Arroyo; 2004, Bourgeois; 2008a, Silberstein et al; 2011, Taketomo et al; 2008).
Ventajas: tiene un amplio espectro terapéutico, sólo igualable en la actualidad por alguno de los nuevos FAE (Lamotrigina: LTG, Topiramato: TPM, Levetiracetam: LEV y Zonisamida: ZNS), presenta eficacia contrastada frente a todos los tipos de crisis de la infancia (incluyendo espasmos infantiles, crisis tónicas, crisis atónicas y crisis reflejas), existe una presentación oral en suspensión que facilita su dosificación, se han desarrollado formas “crono” de liberación sostenida que mejoran el cumplimiento del tratamiento en adolescentes, y existe además una formulación parenteral que permite su uso en las convulsiones agudas y en el SE (convulsivo o no convulsivo).
Inconvenientes y defectos: presenta una cinética dosis-dependiente decreciente por saturación de la unión a las proteínas plasmáticas, presenta frecuentes interacciones farmacocinéticas (CBZ, PB, PHT, LTG), existe riesgo de toxicidad hepática (principalmente, en niños menores de 2 años de edad), puede precipitar descompensaciones metabólicas (acidurias orgánicas y enfermedades mitocondriales), y presenta efectos adversos neurológicos (temblores, déficit atencional, encefalopatía aguda o subaguda), digestivos (vómitos, dolor abdominal, anorexia, pancreatitis aguda), hematológicos (trombopenia, alteración de factores de coagulación), cosméticos (alopecia, hirsutismo) y endocrinológicos (obesidad, amenorrea y síndrome de ovarios poliquísticos en adolescentes).
6. Etosuximida (ESM) (Herranz; 2004, Glauser; 2004b, Bourgeois; 2008b, Silberstein et al; 2011, Taketomo et al; 2008).
Ventajas: es un fármaco con eficacia contrastada en la epilepsia ausencia infantil. También es eficaz en las crisis mioclónicas.
Inconvenientes y defectos: produce con frecuencia efectos adversos digestivos (anorexia, vómitos, dolor abdominal), existe una limitada gama de presentaciones (tan sólo cápsulas orales) y, actualmente, en España, no se dispone de una formulación en suspensión oral.
7. Benzodiacepinas (BZD) (Herranz; 2004, Dalby; 2004, Sato et al; 2004, Greenfield et al; 2004, Farrell et al; 2008, Silberstein et al; 2011, Taketomo et al; 2008, Riss et al; 2008).
Además del uso de diazepam (DZP), clonazepam (CNZ), lorazepam (LZP) y midazolam (MDZ) por vía i.v. para el tratamiento de las convulsiones agudas y el SE, existe además la posibilidad de emplear CNZ, clobazam (CLB) y nitrazepam (NTZ) para el tratamiento crónico de las crisis. Actualmente, se prefiere usar CLB por la menor somnolencia y broncorrea que produce con respecto a las otras BZD. En nuestro país, es actualmente anecdótico el empleo de NTZ.
Ventajas: son eficaces en todos los tipos de crisis. Presentan valor terapéutico contrastado en el tratamiento en politerapia de las crisis mioclónicas, en las encefalopatías epilépticas y en las crisis parciales rebeldes a otros FAE. También son especialmente útiles en las epilepsias generalizadas secundarias.
Inconvenientes y defectos: suelen desarrollar tolerancia durante los primeros 6 meses de tratamiento, producen frecuentes efectos adversos neurológicos (somnolencia, cambios de conducta, alteración en el patrón de sueño, ataxia y deterioro neurocognitivo), digestivos (estreñimiento) y respiratorios (broncorrea).
8. Sultiamo (STM) (Herranz;2004, Meierkord; 2004, Rating et al; 2008).
Ventajas: tiene una eficacia contrastada en epilepsias parciales (especialmente, en la epilepsia benigna rolándica), síndromes epilépticos con punta-onda continua en sueño lento y síndromes de regresión autista epiléptica.
Inconvenientes y defectos: interacciona con PHT (potenciando la toxicidad de este FAE) y presenta frecuentes efectos adversos digestivos. No está comercializado en España.
Nuevos FAE o FAE de segunda generación (Brodie; 2010, Herranz; 2004, Shorvon et al; 2004, Pellock et al; 2008a, Silberstein et al; 2011, Taketomo et al; 2008, Aicardi; 1998, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008).
Incluye aquellos FAE comercializados entre los años 1.990 y 2.005. Tienen unos rasgos farmacológicos comunes que incluyen (Aicardi; 1998, Herranz; 2004, Chung et al; 2008): mecanismos de acción específicos (sobre canales, receptores, proteínas de la vesícula sináptica, etc.), eficacia bien definida para crisis parciales, la dosis en mg/Kg/día no está bien delimitada para todos ellos, existe aún poca experiencia global en monoterapia, se desconocen aún algunos datos de su perfil de seguridad, algunos de ellos pueden producir reacciones idiosincrásicas, tienen una cinética predecible, generan pocas interacciones, no es necesario realizar niveles séricos ni controles de analítica sanguínea, pero son globalmente caros.
En este grupo, se incluyen vigabatrina (VGB), lamotrigina (LTG), felbamato (FBM), gabapentina (GBP), tiagabina (TGB), pregabalina (PRG), oxcarbazepina (OXC), topiramato (TPM), levetiracetam (LEV) y zonisamida (ZNS).
1. Vigabatrina (VGB) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Aicardi; 1998, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Krämer; 2004, Krämer et al; 2008).
Ventajas: es útil en los espasmos infantiles (principalmente, en el síndrome de West secundario; sobre todo si se trata de una esclerosis tuberosa) y en las epilepsias focales (principalmente, en displasias corticales focales). Tiene una cinética cercana a la ideal (ausencia de unión a proteínas plasmáticas, excreción renal sin metabolismo y escasas interacciones medicamentosas), y su uso crónico no produce deterioro neurocognitivo.
Inconvenientes y defectos: es importante realizar una introducción y una retirada lentas de este FAE, para obviar posibles efectos adversos y cambios en el patrón de crisis. Puede producir una reducción periférica concéntrica del campo visual en el 22% de los adultos y en el 15% de los niños que han tomado más de 3 años consecutivos este FAE (Krämer et al; 2008). Es frecuente que induzca aumento de apetito y peso, sobre todo en aquellos casos que toman VGB + VPA. Puede originar efectos adversos neurológicos como somnolencia, mareo y diplopia, y existe riesgo de desarrollar alteraciones comportamentales graves o psicosis. Por otra parte, se ha descrito un empeoramiento paradójico de las mioclonías y las ausencias. Es posible el desarrollo de tolerancia de forma evolutiva y existe un alto riesgo de crisis tras la retirada rápida de este FAE, de forma similar a lo que ocurre con PB y BZD.
2. Lamotrigina (LTG) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Aicardi; 1998, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Matsuo; 2004, Pellock; 2008b).
Ventajas: tiene un amplio espectro terapéutico y es eficaz en todos los tipos de crisis, con un patrón de espectro similar al VPA, con el cual presenta además sinergismo. No induce cinéticamente a otros FAE, aunque sí se han comunicado casos de autoinducción. No altera el nivel de alerta y atención. Por otra parte, se han descrito mejorías neurocognitivas y comportamentales con el tratamiento crónico con este FAE en niños. Tiene una potencial utilidad en los síndromes de regresión autista epiléptica.
Inconvenientes y defectos: es importante realizar una escalada lenta de dosis, sobre todo si se realiza tratamiento concomitante con VPA, para evitar el desarrollo de efectos adversos cutáneos graves. Tiene una cinética poco favorable, con metabolismo hepático, ligazón a proteínas hasta en un 55%, interacciones múltiples con otros FAE (CBZ, PB, PHT, VPA) y posibilidad de inducción de otros FAE sobre la LTG. Puede producir efectos adversos idiosincrásicos cutáneos graves (eritema multiforme, síndrome de Stevens-Johnson, síndrome de Lyell) relacionados con escalada rápida de este FAE, dosis elevadas y/o tratamiento concomitante con VPA. Puede empeorar las crisis mioclónicas; principalmente, en la epilepsia polimorfa de Dravet y en la epilepsia mioclónica juvenil.
3. Felbamato (FBM) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Aicardi; 1998, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Leppik; 2004, Bourgeois; 2008c).
Ventajas: tiene un amplio espectro terapéutico. Es altamente eficaz en el síndrome de Lennox y en las epilepsias parciales. Presenta sinergismo con VPA.
Inconvenientes y defectos: su empleo se encuentra muy restringido por la publicación de efectos adversos graves (anemia aplásica y hepatitis tóxica) y se halla condicionado a un tratamiento con protocolo de uso compasivo, con realización de controles analíticos cada 2 semanas y notificación precoz de cualquier posible anomalía. Además, tiene metabolismo hepático y presenta múltiples interacciones con otros FAE (PHT, PB, CBZ, VPA, CLB).
4. Gabapentina (GBP) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Aicardi; 1998, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Browne; 2004, Holmes et al; 2008).
Ventajas: cinética cercana a la ideal, posibilidad de instauración rápida de dosis, no presenta interacciones y tiene una excelente tolerabilidad. Útil para pacientes con patología sistémica o en tratamiento con múltiples fármacos (por ejemplo, pacientes oncológicos).
Inconvenientes y defectos: puede empeorar ciertas crisis (ausencias, mioclonías y crisis atónicas), tiene una absorción digestiva irregular, presenta una cinética dosis-dependiente decreciente con posible desarrollo de tolerancia (cuanta más dosis se administra, menor es la cantidad absorbida, por saturación de los mecanismos transportadores de la mucosa intestinal, lo cual obliga a aumentar considerablemente las dosis de forma evolutiva) y tiene una vida media corta (se administra en 3 tomas al día). Su eficacia en crisis parciales está bien contrastada en la población adulta, pero los estudios en niños son contradictorios y actualmente no parece ser un FAE de primer nivel en Neuropediatría.
5. Tiagabina (TGB) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Aicardi; 1998, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Kälviäinen; 2004, Shinnar et al; 2008).
Ventajas: no altera el campo visual, a diferencia de lo referido con la VGB.
Inconvenientes y defectos: tiene un metabolismo hepático inducible, presenta una vida media corta (se administra en 3 tomas al día), muestra interacción con FAE inductores, se liga hasta en un 95% a proteínas plasmáticas y puede empeorar algunas crisis (ausencias, mioclonías y crisis atónicas). Se recomienda una escalada lenta de dosis para minimizar los posibles efectos adversos neurocognitivos. Tiene una eficacia contrastada para crisis parciales en la población adulta, pero la información es escasa y contradictoria para la población pediátrica.
6. Topiramato (TPM) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Aicardi; 1998, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Cross; 2004, Glauser; 2008).
Ventajas: tiene un amplio espectro terapéutico, siendo eficaz en todos los tipos de crisis, incluyendo su posible uso en epilepsias refractarias como el síndrome de Lennox, el síndrome de Dravet y el síndrome de West. Posee una cinética favorable, con escasa ligazón a proteínas, excreción renal y escasas interacciones con otros FAE (tan sólo interactúa con PHT y CBZ). Se especula sobre su posible efecto neuroprotector.
Inconvenientes y defectos: es importante realizar una escalada lenta de dosis, sobre todo si se introduce en politerapia, para minimizar la posibilidad de efectos adversos. Los problemas derivados de sus efectos secundarios incluyen efectos neurocognitivos sobre memoria y lenguaje (relacionados con politerapia, inicio de terapia con dosis altas, escalada rápida de dosis y/o dosis altas de TPM mantenidas), anorexia y pérdida de peso, parestesias y litiasis renal. Es un fármaco que se tolera mucho mejor en monoterapia y con escalada muy lenta de dosis, siendo entonces excepcional la presencia de efectos adversos neurocognitivos graves.
7. Oxcarbacepina (OXC) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Dodson; 2008b, Faught; 2004).
Ventajas: mejor tolerada globalmente que CBZ, con menor tasa de efectos adversos idiosincrásicos cutáneos (5%) y hematológicos (Dodson; 2008b), escasas interacciones farmacológicas, eficacia contrastada frente a crisis parciales y crisis focales secundariamente generalizadas, y adecuada formulación pediátrica (suspensión oral). Por otra parte, es una alternativa eficaz y segura a la CBZ en aquellos niños que presentaron una respuesta terapéutica a ese FAE pero tuvieron que suprimirlo por desarrollar efectos adversos intolerables.
Inconvenientes y defectos: posibilidad de presentar hiponatremia (efecto excepcional en niños) y potencial riesgo de efectos adversos cutáneos graves, aunque infrecuentes, tipo eritema multiforme o síndrome de Stevens-Johnson.
8. Levetiracetam (LEV) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Sadek et al; 2004, Sankar et al; 2008).
Ventajas: tiene un amplio espectro terapéutico, con una alta eficacia frente a epilepsias parciales y generalizadas; presenta una cinética lineal muy próxima al FAE ideal, sin ligazón a proteínas ni metabolismo hepático ni interacciones medicamentosas significativas. Se puede dosificar de forma rápida y alcanza precozmente el estado de equilibrio. Se dispone de una presentación en forma de suspensión oral y existe una presentación parenteral para su administración i.v. en las crisis agudas repetitivas y en el SE. Es un FAE con un excelente balance entre eficacia y seguridad y se muestra especialmente útil frente a epilepsias parciales y epilepsias mioclónicas.
Inconvenientes y defectos: en algunos pacientes, con dosis altas desde el inicio o con una dosificación demasiado rápida, pueden presentase efectos secundarios neurocognitivos como somnolencia o irritabilidad, aunque suelen ser efectos adversos leves y transitorios.
9. Pregabalina (PRG) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Ben-Menachen et al; 2004, Holmes; 2008)
Ventajas: tiene una cinética lineal y predecible, se elimina por excreción renal sin metabolismo hepático, no se une a proteínas plasmáticas y no presenta interacciones reseñables. Parece ser útil como terapia añadida en las epilepsias parciales. Inconvenientes y defectos: no existe aún suficiente experiencia pediátrica. Produce efectos adversos neurológicos (somnolencia) y ganancia excesiva de peso.
10. Zonisamida (ZNS) (Herranz; 2004, Silberstein et al; 2011, Taketomo et al; 2008, Chung et al; 2008, Weijenberg et al; 2010, Hwang et al; 2008, Seino et al; 2004, Kerrigan et al; 2008).
Ventajas: tiene un amplio espectro terapéutico, es eficaz en crisis generalizadas (adecuado perfil para ausencias refractarias) y parciales (alta tasa de respuesta en epilepsias frontales), desarrolla pocas interacciones con FAE, es útil en encefalopatías epilépticas tipo síndrome de West y síndrome de Lennox, y también es eficaz en crisis mioclónicas.
Inconvenientes y defectos: se han descrito EA variados como litiasis renal, alteraciones neurocognitivas (similares a las del TPM) y conductuales (potencial riesgo de psicosis) y, ocasionalmente, EA sistémicos (hipersensibilidad con afectación cutánea y/o hematológica).
FAE de tercera generación (Brodie; 2010, Shorvon et al; 2004, Pellock et al; 2008a, Silberstein et al; 2011, Taketomo et al; 2008, Patsalos et al; 2004, Pollard et al; 2008, Armijo et al; 2006, Luszczki; 2009, Vohora et al; 2010).
Incluye aquellos FAE comercializados a partir del año 2.005. Muchos de ellos son FAE de diseño para síndromes epilépticos específicos y con mecanismos de acción novedosos.
En este grupo, se incluyen: rufinamida (RFM), estiripentol (STP), lacosamida (LCM) y acetato de eslicarbazepina (ESL). Algunos FAE están aún en fase de ensayo, incluyendo: retigabina, brivaracetam, carisbamato, talampanel, perampanel y ganaxolona.
1. Rufinamida (RFM) (Silberstein et al; 2011, Taketomo et al; 2008, Patsalos et al; 2004, Pollard et al; 2008, Armijo et al; 2006, Luszczki; 2009, Vohora et al; 2010, Biton; 2004, Herranz; 2008). Es un FAE autorizado por la EMEA (agencia europea del medicamento) como orphan drug para el tratamiento de las crisis del síndrome de Lennox-Gastaut en niños mayores de 4 años de edad.
Ventajas: es un FAE de amplio espectro, útil en síndromes epilépticos infantiles con pocos FAE eficaces (síndrome de Lennox y encefalopatías similares) y en epilepsias parciales refractarias (principalmente, frontales y multifocales).
Inconvenientes y defectos: presenta interacciones con FAE (VPA, CBZ, PB, PHT) y con los estrógenos, existen EA neurológicos (somnolencia, irritabilidad e insomnio) y sistémicos (vómitos y anorexia), principalmente cuando se asocia con VPA. Se debe hacer una titulación inicial lenta, principalmente si se emplea junto con VPA, para minimizar la tasa de EA.
2. Lacosamida (LCM) (Silberstein et al; 2011, Taketomo et al; 2008, Patsalos et al; 2004, Pollard et al; 2008, Armijo et al; 2006, Luszczki; 2009, Vohora et al; 2010, Chung; 2010, Gavatha et al; 2011). Es un nuevo FAE de tercera generación aprobado por la EMEA como terapia añadida para la epilepsia focal del adulto.
Ventajas: eficaz en epilepsia refractaria, útil en epilepsias focales, mecanismo de acción novedoso (potencia la inactivación lenta del canal de sodio dependiente de voltaje: NaV), rápido inicio de acción, farmacocinética bien definida y cercana a la ideal, baja tasa de interacciones, dosis infantil bien definida, posible empleo intravenoso, presentación en suspensión oral, baja frecuencia de EA, efecto sinérgico con LEV y potencial efecto neurocognitivo positivo.
Inconvenientes y defectos: existe aún poca experiencia en el niño, espectro restringido a crisis focales, EA neurológicos (diplopía, visión borrosa y mareo) que son más frecuentes si se asocian otros FAE que actúen sobre NaV (CBZ, OXC, LTG, PHT), potenciales interacciones farmacodinámicas con FAE que actúan sobre NaV.
3. Estiripentol (STP) (Silberstein et al; 2011, Taketomo et al; 2008, Patsalos et al; 2004, Pollard et al; 2008, Armijo et al; 2006, Luszczki; 2009, Chiron; 2000, Chiron et al; 2005). Es un FAE autorizado por la EMEA como orphan drug para las crisis del síndrome de Dravet.
Ventajas: es un FAE de amplio espectro que se muestra útil en síndromes epilépticos con pocos FAE eficaces (síndrome de Dravet y Dravet-borderland) así como en las epilepsias multifocales.
Inconvenientes: múltiples interacciones derivadas de su actuación sobre citocromo hepático CYP-P450, EA neurológicos (somnolencia, ataxia) y digestivos (vómitos, anorexia), principalmente cuando se combina con VPA y CLB a los que potencia claramente en eficacia y toxicidad. Riesgo de disfunción hepática e hiperamoniemia en los casos que combinan VPA+STP+TPM.
4. Acetato de eslicarbazepina (ESL) (Silberstein et al; 2011, Taketomo et al; 2008, Patsalos et al; 2004, Pollard et al; 2008, Armijo et al; 2006, Luszczki; 2009, Vohora et al; 2010, Owen; 2010, Landmark et al; 2008). Es un profármaco que libera en sangre S-Licarbazepina (metabolito activo de OXC).
Ventajas: eficaz en epilepsias parciales refractarias, menos EA que OXC, ausencia de deterioro cognitivo, posibilidad de administrar en una única toma al día, ausencia casi completa de interacciones.
Inconvenientes y defectos: escasa experiencia en población infantil, ausencia de presentaciones pediátricas, presencia de EA neurológicos (diplopia, mareo, visión borrosa, vértigo), necesidad de hacer una escalada lenta de dosis en niños para minimizar los EA.
5. Otros FAE de tercera generación: se están desarrollado o se han desarrollado ya nuevos FAE que suponen nuevas estructuras y/o nuevos mecanismos de acción y nuevos FAE que son análogos o derivados de otros FAE ya existentes en el mercado, incluyendo en estos 2 grupos (Patsalos et al; 2004, Pollard et al; 2008, Armijo et al; 2006, Luszczki; 2009, Vohora et al; 2010, Landmark et al; 2008, Rogawski; 2011), diversos FAE como: Safinamida (SAF): inhibidor de los Nav; Losigamona (LSG): inhibidor de los Nav; Retigabina (RTG): activador de canales de potasio; Ganaxolona (GNX): esteroide neuroactivo con efecto gabaérgico; Talampanel (TLP): antagonista de receptores AMPA del glutamato; Perampanel (PRP): antagonista de receptores AMPA del glutamato; Remacemida (RMC): antagonista del receptor NMDA del glutamato; Análogos de las BZD: ELB-139 (para disminuir EA y tolerancia); Análogos del FBM: fluorofelbamato (FFBM) y carisbamato (CBM) (para mejorar la tolerabilidad); Análogos de la GBP: XP-13512 (para mejorar la absorción oral); Análogos de la LTG: JZP-4 (para mejorar su tolerabilidad); Análogos del LEV: brivaracetam (BRI) y seletracetam (SEL) (para mejorar eficacia); Análogos del VPA: valrocemida (VLR), valnoctamida (VLN), derivados cíclicos de VPA, y derivados conjugados de aminoácidos (derivados de valrocemida y derivados de valnoctamida) (con el fin de disminuir toxicidad hepática, disminuir EA hemáticos y neurológicos y mejorar su efecto positivo conductual).
-Otras medidas farmacológicas en epilepsia infantil.
Se incluyen aquí diversos fármacos con actuación inmunológica y metabólica (Biagini et al; 2010, Devinsky et al; 2008, Auvin et al; 2008).
ACTH y corticoides (Biagini et al; 2010, Auvin et al; 2008, Verhelst et al; 2005, Gupta et al; 2005).
Se han usado dosis variables no bien protocolizadas de distintos fármacos como dexametasona, hidrocortisona, prednisona, deflazacort, liposteroide (palmitato de dexametasona), metilprednisolona o ACTH. Por otra parte, se describen pautas de duración muy variables, desde escasas semanas a más de 6 meses. Con todas estas limitaciones, los esteroides siguen manteniendo su utilidad en el tratamiento de los espasmos infantiles (principalmente, en los síndromes de West idiopáticos y criptogénicos) y en los síndromes epilépticos con punta-onda continua durante el sueño lento. Además, se usan en diversas epilepsias refractarias, en situaciones de mal control de crisis. En el grupo de epilepsias refractarias infantiles, la tasa global de respondedores, con más de un 50% de disminución en la frecuencia global de crisis, oscila entre un 25-85%, con series de hasta un 25-71% de pacientes libres de crisis en algún momento de su evolución, pero con hasta un 66% de recaídas evolutivas posteriores (Verhelst et al; 2005, Gupta et al; 2005). Su empleo prolongado se encuentra muy restringido por su alta tasa de EA, incluyendo hipertensión arterial, aumento de la sensibilidad a infecciones, fenotipo Cushing, osteoporosis y retraso de crecimiento.
Inmunoglobulinas intravenosas (IGIV) (Duse et al; 1996, Auvin et al; 2008, Billiau et al; 2007, Feasby et al; 2007).
Es un tratamiento empírico que se ha mostrado relativamente eficaz en determinadas epilepsias refractarias como el síndrome de West, el síndrome de Lennox-Gastaut, el síndrome de Landau-Kleffner y el síndrome de Rasmussen. Se desconoce, sin embargo, cual es la pauta más adecuada de dosis a utilizar, en qué situaciones se deben emplear y durante cuánto tiempo se debe mantener la terapia. En las revisiones que analizan epilepsias refractarias infantiles tratadas con IGIV, se obtienen respuestas con más de un 50% de reducción en la frecuencia global de crisis en un 30-52% de los casos, con remisión completa de crisis en hasta un 23% y con mejorías neurocognitivas y comportamentales en un 50-63% de los tratados (Duse et al; 1996, Billiau et al; 2007, Feasby et al; 2007). Las IGIV son una terapia habitualmente bien tolerada, aunque se han descrito como EA la presencia de reacciones de hipersensibilidad de grado variable, cefaleas agudas, meningitis asépticas, pseudotumor cerebri y alteraciones de la frecuencia cardiaca y la tensión arterial durante la perfusión i.v.
Piridoxina (Devinsky et al; 2008, Campistol; 2000, Gospe; 2006, Basura et al; 2009, Prasad et al; 2006).
Debe considerarse su uso en todo niño menor de 2 años con crisis epilépticas. En los lactantes con crisis frecuentes, SE o síndrome de West, es recomendable probar tratamiento empírico con una dosis parenteral de 100-300 mg de piridoxina para descartar una deficiencia de esta sustancia. En niños con crisis más espaciadas, puede ser útil el tratamiento con 50-100 mg/día de piridoxina, durante unos 3-6 meses, para definir algunos casos de epilepsias piridoxin-sensibles.
Piridoxal fosfato (Devinsky et al; 2008, Wang et al; 2005, Pearl et al; 2007).
Debe considerarse su uso en epilepsias infantiles con crisis refractarias en edad neonatal y en niños menores de 3 años de edad sin etiología definida para la epilepsia. Algunos niños que no responden a piridoxina pueden responder a piridoxal fosfato posteriormente. Se recomiendan pautas con una dosis inicial de 10 mg/Kg i.v. y posteriormente 2,5 mg/Kg/dosis cada 6 horas, durante 3 días. Algunas formas refractarias pueden necesitar hasta 40 mg/Kg. En los casos que responden, se puede continuar luego con 10 mg/kg/día de piridoxina oral.
Biotina (Devinsky et al; 2008, Campistol; 2000, Prasad et al; 2006).
Se debe considerar su uso en las crisis neonatales refractarias, encefalopatías epilépticas neonatales, crisis refractarias en lactantes, espasmos epilépticos refractarios y en todas las epilepsias refractarias y SE refractarios en niños menores de 3 años de edad. Se emplea a una dosis de 20 mg/día por vía oral o intramuscular, siendo bien tolerada globalmente.
Ácido folínico (Devinsky et al; 2008, Campistol; 2000, Nicolai et al; 2006, Frye et al; 2003, Prasad et al; 2006).
Se debe considerar su uso en crisis neonatales rebeldes a FAE, crisis refractarias en lactantes, espasmos epilépticos refractarios y en todas las epilepsias refractarias y SE refractarios en niños menores de 3 años de edad, incluyendo las formas sin respuesta inicial a piridoxina ni a piridoxal fosfato ni a biotina. Se utiliza a una dosis de 5-10 mg cada 12 horas por vía oral, siendo bien tolerado globalmente.
Acetazolamida (Neufeld; 2004, Katayama et al; 2002).
Actúa como inhibidor de la anhidrasa carbónica, de forma similar a TPM o ZNS. Es útil en el tratamiento de las crisis mioclónicas, de las ausencias refractarias y para la descompensación de crisis en las encefalopatías epilépticas con abundantes crisis motoras menores (por ejemplo, síndrome de Lennox-Gastaut). Produce con frecuencia vómitos y dolor abdominal y debe monitorizarse el desarrollo evolutivo de acidosis metabólica e hipokaliemia.
Bromuros (Korinthenberg et al; 2007, Ryan et al; 1999).
Fue el primer grupo de FAE que se empleó, en fecha tan lejana como el siglo XIX, y hoy vuelve a considerarse su uso dado que constituyen un FAE barato, eficaz en síndromes epilépticos “catastróficos” (epilepsia migratoria maligna del lactante y síndrome de Dravet, entre otros). Sin embargo, la alta tasa de efectos adversos (cutáneos, neurológicos y digestivos), la escasa información sobre su uso clínico, y la ausencia de preparados comerciales en España, limitan actualmente su empleo. Se han descrito respuestas globales (más de un 50% de reducción de frecuencia global de crisis) en un 50-75% de los tratados, con hasta un 25-35% libre de crisis (Korinthenberg et al; 2007). Las mejores respuestas se obtienen en crisis generalizadas tónico-clónicas, crisis parciales, crisis mioclónicas, crisis atónicas, y en los SE de crisis motoras menores. Se emplean dosis con un rango de 10-100 mg/Kg/día. Pueden emplearse como sales de bromuro sódico, bromuro potásico, bromuro amónico, o bien una mezcla de las tres.
Hidrato de cloral (Hindley et al; 2005, Krsek et al; 2002).
Se han descrito casos anecdóticos de síndrome de Ohtahara que sólo se controlaron en su evolución refractaria tras la administración de hidrato de cloral a dosis altas de hasta 50-60 mg/Kg/día (Krsek et al; 2002). También se han descrito respuestas terapéuticas variables en síndromes de Dravet y epilepsias migratorias malignas del lactante (Hindley et al; 2005). Se puede emplear por vía rectal (enemas) o bien por vía oral (jarabe). Como EA, se describe riesgo de apneas obstructivas y excesiva sedación.
Análogos de la hormona TRH (Ishii et al; 1990, Takeuchi et al; 2001).
En el grupo de encefalopatías epilépticas neonatales, se ha conseguido una respuesta terapéutica con supresión de crisis, pero no de forma mantenida, en algunos pacientes, empleando dosis intravenosas de 0,5 mg/día (Ishii et al; 1990). Por otra parte, en encefalopatías epilépticas de lactantes y preescolares, se ha empleado TRH por vía intramuscular para tratar tanto síndrome de West como síndrome de Lennox, con hasta un 50% de pacientes respondedores, incluyendo un 33% que quedaron libres de crisis (Takeuchi et al; 2001).
Antagonistas del calcio (Pascual-Castroviejo; 1990, Iannetti et al; 2009).
Se ha empleado verapamilo en el síndrome de Dravet, con una excelente respuesta a este bloqueante del calcio en 2 pacientes con alta frecuencia de crisis y SE de repetición (Iannetti et al; 2009). Se especula con que este fármaco podría inhibir la glicoproteína P, proteína transportadora ligada a fenómenos de multirresistencia a FAE, y podría también regular la depolarización neuronal. Por otra parte, se ha usado nicardipina en epilepsias con punta-onda continua en sueño, con una respuesta positiva a este fármaco bloqueante del calcio, a dosis de 0,5-2,0 mg/Kg/día, en el 100% de los pacientes tratados (Pascual-Castroviejo; 1990).
Fármacos con potencial acción sobre epileptogénesis y/o sobre la progresión de la epilepsia (Pitkänen; 2010).
Se incluyen aquí diversos fármacos como: inmunosupresores (rapamicina y everolimus, como inhibidores de la vía mTOR, y el FK506 como inhibidor de linfocitos T), antiinflamatorios no esteroideos (celecoxib, parecoxib y SC58236, como inhibidores de COX-2), antiinflamatorios vía adhesión leucocitaria a endotelios (anticuerpo monoclonal específico para integrina A4), fármacos que actúan sobre proliferación celular y plasticidad celular (eritropoyetina, por su efecto neurotrófico y antiapoptótico, y duoterapia sobre genes FGF-2 y BDNF de la vía de las neurotrofinas), y el efecto paradójico de algunos proconvulsivantes (atipamezol, por bloqueo de α2-receptores, y rimonabant, como antagonista de receptores cannabinoides).
- Actuación farmacológica ordenada (Arzimanoglou et al; 2004, Herranz; 2004, Gutiérrez-Solana et al; 1998, Guerrini; 2006; Shorvon; 2000, Shorvon et al; 2004; Pellock et al; 2008, Chen; 2011, Liga Española contra la Epilepsia; 2003, Shih et al; 2009).
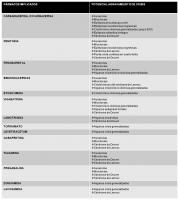
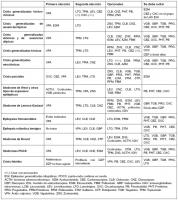
Realizaremos nuestra selección de FAE en base a los criterios previamente enumerados en el apartado anterior, considerando el perfil de cada FAE para los distintos tipos de crisis, epilepsias y síndromes epilépticos (ver “selección de los distintos FAE según tipo de crisis, epilepsia y síndrome epiléptico.jpg”) y (ver “pautas de dosis de FAE en la edad pediátrica.jpg”) .
Comenzaremos con monoterapia con un FAE de primera elección (primer nivel de selección de FAE o FAE de primera elección). Si persisten las crisis, debemos reconsiderar el diagnóstico de epilepsia, comprobar la dosis usada y alcanzar, si es posible, la “dosis máxima tolerable”. Se debe valorar el cumplimiento del tratamiento (ante la duda, haced niveles de medicación en sangre). Por otra parte, hay que considerar una posible lesión estructural y realizar una RM cerebral, si no se hizo previamente.
Consideraremos añadir un segundo FAE de primer nivel y después retirar gradualmente el primero que se usó. Realizaremos estos cambios siempre que comprobemos que la medicación es claramente ineficaz tras llegar a la “dosis máxima tolerable” del FAE en monoterapia y/o cuando existe un mal balance entre eficacia y tolerabilidad para un determinado FAE.
Si a pesar de eso persisten las crisis, se puede ensayar un tercer FAE e iniciar la retirada del segundo, para intentar mantener en monoterapia. Sin embargo, es frecuente llegar desde aquí a biterapia o politerapia.
Si todavía persistieran las crisis, combinaremos inicialmente 2 FAE de primer nivel y posteriormente valoraremos mantener el FAE más eficaz de los usados de primer nivel y añadir un FAE de segundo nivel.
- Retirada del tratamiento antiepiléptico (Arzimanoglou et al; 2004, Herranz; 2004, Gutiérrez-Solana et al; 1998, Guerrini; 2006; Shorvon; 2000, Shorvon et al; 2004; Pellock et al; 2008, Chen; 2011, Liga Española contra la Epilepsia; 2003, Shih et al; 2009, Ranganathan et al; 2006, Specchio et al; 2004, Baulac et al; 2003, Ramos-Lizana et al; 2010, Hixson; 2010 ).
Conceptos generales (Gutiérrez-Solana et al; 1998, Shih et al; 2009, Ranganathan et al; 2006, Ramos-Lizana et al; 2010).
El 85% de las recaídas ocurren en el primer año tras el inicio de la retirada y, sobre todo en los 6 primeros meses, donde se agrupan hasta un 50% de los casos. El riesgo de recurrencia global tras la retirada del FAE es de un 23-25% a los 2 años de la supresión del tratamiento y de un 28-30% a los 5 años. Hasta un 33% de los pacientes que presentan una recaída tras el inicio de la supresión del FAE, permanecen después libres de crisis